ELEKTRONEN
VdW —
UNIVERSUMS HISTORIA enligt relaterad fysik | 2010VII13 | 2010VIII18 | en![]() produktion
| Senast uppdaterade version: 2011-08-21 · Universums Historia
produktion
| Senast uppdaterade version: 2011-08-21 · Universums Historia
innehåll · webbSÖK äMNESORD på
denna sida Ctrl+F · sök ämnesord överallt i SAKREGISTER · förteckning över alla webbsidor
Brotthållfasthet OCH MATERIALLÄRA ·
Grundläggande begrepp inom materialläran — Om materialens sammanhållande
krafter — Elektronen och elektronmassans komponenter — Kohesion och Adhesion — Kraft och
Energi
BILDKÄLLA:
Författarens arkiv · Bild4 Excur4 ·19apr2010 · Nikon D90 · Detalj
Det verkar inte finnas några allmänt etablerade ENKLA ELEMENTÄRA
matematiska sambandsuttryck för begreppet atomär-molekylär KOHESION
i MAC
— trots enkla analogier. Däremot används frekvent
sambandsformer som associeras med van der Waals krafter
för att beskriva ADHESION
— trots att samma matematiska typuttryck just ger KOHESIONSMATEMATIKEN på
enklaste form. »Den uppmärksammade förbistringen» har föranlett det här
dokumentet. Forts.
ELEKTRONEN — materien
Begreppsbeskrivningar
enligt relaterad fysik [TNED] — med jämförelser och
korsreferenser till MAC
|
Elektronassocierade
Artiklar |
||||
|
|
|
Brottgränser — Rm Experiment — Teori |
Elektronens frigörelse ur atomkärnan: |
|
|
|
— enkel grundgeometri — |
Kärnassocierade
artiklar |
Se även i Förklaringarna till begreppen i den moderna akademins
kvantelektrodynamik (QED) från 1947.
Grundbegreppens förankring i fysiken, hur de uppkommit — och
deras innebörd i relaterad fysik (TNED)
Allmänna artikelrubriker — Elektronen i materien
Parbildning — Hur positronbildning i MAC framställs som
skapelse av materia
Van der Waals
krafter — angående materiens sammanhållande krafter, Materialens
hållfasthet och kemiska bindningsenergiinnehåll
För Elektronelementet, se Elektronen, ELEKTRONMASSANS KOMPONENTER, Ljusets
Polarisation, Spektrum och Kvanttalen.
För BT, se Atomkärnans allmänna magnetiska yttoroidfält.
Elektronens
frigörelse ur atomkärnan:
NEUTRONSÖNDERFALLET ![]() laddningsdeplacementet
laddningsdeplacementet
NEUTRONSÖNDERFALLET ![]() kärnmagnetismen
kärnmagnetismen
ATOMKÄRNAN ![]() allmän
formbeskrivning
allmän
formbeskrivning
kärnanod, BT-fältet.
Grundämnesmetallernas brotthållfasthet [Rm] — inledning
Grundämnesmetallernas brotthållfasthet
— approximativt via vätebindningen
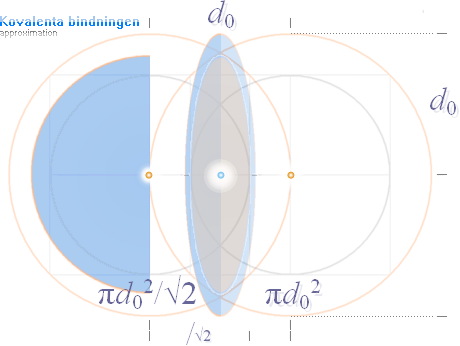
Vänster: Stiliserad ikonbild av kovalenta bindningens geometriska
fysik, cirkelradien = d0, samma som atommedelavståndet: Två Väteatomer
sammanbinds [»kedjas»] av en mellanliggande gemensam elektronmassa. Bindningskraften i fallet
Väteatom-Väteatom är (här veterligt) den allra starkaste som finns i fysiken. Se Jämförande
tabeller — Kovalenta bindningar.
Höger: Förminskad diagrambild
[klicka på bilden för större] av Grundämnesmetallernas brotthållfasthet, jämförelse mellan
Experimentellt uppmätta [ljusvioletta] och Beräknade [mörkblå] enligt
vänsterfigurens helt enkla basgeometri, vidare nedan.
Den enkla kovalenta bindningsgeometrin
— figuren ovan vänster med Coulombekvationen F=ke(e/d0)2
som motsvarar fallet med Väte [Atomnummer Z=1, se även utförligt i Vätebindningen H—H] — ger en approximativt samstämmig överensstämmelse med
experimentella brotthållfasthetsdata [MatWeb]
på de olika grundämnesmetallerna.
PRINCIP:
Den enkla F-formen ke(e/d0)2
används genomgående för alla grundämnesmetallerna [från och med atomnummer Z=3,
Litium] — med enda tillägget att resultatet divideras med atomnumret (Z).
Ytkraften F/A fås genom division med cirkulära flödestvärsnittets yta
för mittcirkel A=[A=π[d0/2]2]/√2=πd02/√2, som ger F/A=kee2/(π·d04·√2).
Z-divisionen motsvarar dämpningen i
attraktionen via den växande repulsionskraft som framträder via atomer med
växande atomnummer, analogt större kärnladdning. Resultatet av den modifierade
F/A-formen visas i Diagram Rm1. Med en enklare justering för den ytterligare
exponentiella dämpningen av kärnkraftsrepulsionen vid låga Z, samt en
marginellt linjär kompensation som dämpar ytterligare för höga Z, ges det
justerade resultatet i Diagram Rm2 (originalet till den förminskade bilden ovan höger),
sambandet nedan.
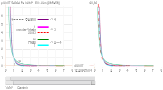
F/A = (100[8Z(t6) + 2([Z–1]/2)–2])(1/Z)kee2/(π·d04·√2) ............ N/M² = Pa
Approximation till Grundämnesmetallernas
brottgränser, se Diagram Rm2.
Genom
separat undersökning visar det sig att ovanstående approximationsform uppvisar
(nära) samma variationsstruktur som Medelatomkubiska Elektronmassatätheten, Zm(e)/d03.
Denna visas här nedan infälld i tonat gult i bakgrunden till jämförelse med
förgrundens Diagram Rm2.
Diagram Rm3 — Diagram
Rm1 · Diagram Rm2
Brotthållfastheten (MPa) för
grundämnesmetallerna .............. Serie1, Rm =
(100[8Z(t6) +
2([Z–1]/2)–2])(1/Z)kee2/(π·d04·√2), Pa; Serie 1 i MPa
Experimentellt uppmätta Rm-värden ....................................... Serie2, MatWeb-data, MPa Serie 2
Medelatomkubiska Elektronmassatätheten
.......................... ........., Zm(e)/d03,
KG/M3 gult fält i bakgrunden med ljusblå värdepunkter
Vätebindningen
H—H vid Z=1 här medtagen för
referens [Elektronmassatäthetsvärdet 2,25 KG/M³].
Serie
12 i MPa, Elektronmassatätheterna i KG/M³.
För vidare diagramdetaljer, se Diagram Rm2 och Diagram Rm1.
Trots
att resultatbilden ingalunda är exakt, ger den ändå
1. (i
vissa partier) en förvånansvärt god översiktsbild av HUR materiebildens
hållfasthetsfysik sammanhänger med ENKLA sambandsformer i PERIODISKA
SYSTEMET,
2. en
tämligen noggrann sammanfattning av hela Rm-intervallet
0-1000 MPa för samtliga grundämnesmetaller.
En motsvarande upplysande orienterande
översikt har emotsetts generellt på det fria webbutbudet, men tyvärr ännu inte
påträffats.
Se vidare från Diagram Rm1
[Från Vätebindningen H—H].
Se även allmänt från HÅLLFASTHETSGRUNDERNA (Brotthållfasthet).
BILDKÄLLA:
Författarens arkiv · Bild216 · R2010Apr · 13apr2010 · Nikon D90 · Detalj
Forts.
frn. INLEDNINGEN
Det
är märkligt, främst eftersom man redan (väl) känner energibindningsdata för
olika molekylära grundkopplingar [Se Jämförande tabeller
— Kovalenta bindningar]. Dessa
grunddata kan uttryckas matematiskt approximativt i samstämmighet med
tabellvärdena via enkla grundsamband, se Vätebindningen H—H. Grundsambanden ansluter också tillsammans med
ytterligare alternativa matematiska uttryck och som — just — anknyter till
sambandsformer av den konventionella van der Waals adhesionsmatematiken typ
F/A=K/d^3, se citat, och
som alltså i själva verket tydligen beskriver kohesionsfysiken: materialens brotthållfasthet.
I MAC [Se Övergången
VdW-Casimir] låter man Casimirsambandets form (1/d^4
— som inte räcker ända fram till atomkopplingarna, se JÄMFÖRANDE FUNKTIONSGRAFER) för speciellt korta avstånd [0,1-20 nM] mellan åtskilda
materialytor övergå i en associerad van der Waals sambandsform (1/d^3);
I TNED finns ingen liknande övergångsform — eftersom
ADHESIONSSAMBANDETS MATEMATIK i TNED (1/d^2TILL4)
täcker hela intervallet min-max, se INLEDNINGEN TILL CASIMIREFFEKTEN I RELATERAD FYSIK. TNED/Casimir-teorin baseras helt på de elektronmassans komponenter som förkastades av MAC från 1927; Bortfallet kompenserades med ett »vakuumets nollenergi», se från Casimireffekten
i MAC.
EN
MÖJLIG FÖRKLARING till avsaknaden i MAC av ENKLA ELEMENTÄRA GRUNDSAMBAND för (speciellt) kohesionen i materialsammanhang, kanske blir bäst belyst genom att
studera en av de (få) webbkällor som diskuterar några sambandsformer alls i
samband med kohesionsbegreppet,
Philosophical
Transactions of The Royal Society — 2009
BOND
ANISOTROPY AND COHESION OF WET GRANULAR MATERIALS — Farhang Radjai1, Vincent
Richefeu
http://rsta.royalsocietypublishing.org/content/367/1909/5123.full
Nämligen
det påtaliga inslaget av
·
(onödigt — om det gäller en
elementär översikt med enkla exempel) komplicerad matematik av arten tensorkalkyl
·
krångliga utläggningar
med universitets-
och högskolematematikens specialtermer som
tydligen bara kan förstås av personer som redan är förtrogna med nomenklaturen
på den nivån
För
TNED:s del; Se exempel i Vätebindningen H—H.
Den möjliga förklaringens svårighet i MAC fördjupas betydligt
genom att det enkla exempelfallet [Se exempel i Vätebindningen
HH] vidrör det som påpekas i INLEDNINGEN:
I MAC används uppenbarligen typformen F/A=K/d3 för att beskriva Adhesion
— som i exempelfallet med Vätebindningen och dess koppling till Kovalenta allmänna atombindningsformen med konkret praktiskt resultatexempel i Diagram Rm2
i själva verket och tydligen beskriver-definierar Kohesion.
Se den mera utförliga inledande
beskrivningen av »förbistringen» på artikeln Kovalenta allmänna atombindningsformen i början av avsnittet om van der Waals krafter.
[Det verkar med andra ord vara ytterst
svårt att beskriva ämnet med utgångspunkt i modern akademi].
I den här presentationen ges en översiktlig
jämförande resultatbild från tillgängliga tabellvärden (MatWeb) via
olika ämnen tillsammans med resultat från beräkningar via de här härledda
sambandsformerna.
Se
även dispositionen genom INNEHÅLLSFÖRTECKNINGEN.

BILDKÄLLA:
Författarens arkiv · Bild5 Adhesion · 5nov2010 · Nikon D90
GRUNDLÄGGANDE BEGREPP I MATERIALLÄRAN
Kohesion och Adhesion
INLEDANDE PRAKTISK ORIENTERING I
GRUNDBEGREPPEN
![]()
Termdefinitioner, etymologiskt
KOHESION [av lat. cohae´rere, sammanhänga] används generellt i
facklitteraturen för att beskriva ett materials INRE sammanhållning.
ADHESION [av lat. ad, till, vid, och
haere´re, hänga] används generellt i facklitteraturen för att beskriva
sammanhållning MELLAN olika materialdelar.
Exempel på etablerad facklitteratur som
beskriver begreppen kohesion och adhesion;
”I vätskans gränsyta mot en fast kropp
finns också en ytspänning, som i detta fall emellertid inte enbart bestäms av krafterna
mellan vätskepartiklarna, kohesionskrafterna, utan också av
de krafter som verkar mellan vätskepartiklarna och partiklarna
i den fasta kroppens yta, adhesionskrafterna.”, FOCUS
MATERIEN 1975 s180sp2n.
Praktiska
exempel som visar inverkan av kohesion och adhesion framgår dels med hjälp av vattendroppar på olika
material och dels med hjälp av vattenfyllning i kärl med olika material. Vi
studerar några enkla köksexempel.

BILDKÄLLA: Författarens arkiv ·
Bild5 Adhesion · Nedan Bild7 · 5nov2010 · Nikon D90
Adhesion, praktiskt köksexempel. Bilden ovan visar hur vattenlinjen i en plastbägare [höger] skiljer
sig markant från vattenlinjen i ett glas [vänster]. Medan plastbägaren uppvisar
en synbart helt rak koppling ![]() mellan kärlvägg och vattenyta utan någon
synbar kurvering, uppvisar glaset en markant rundad
mellan kärlvägg och vattenyta utan någon
synbar kurvering, uppvisar glaset en markant rundad ![]() övergång. Övergången i glasfallet syns som en
ganska precis 3 mM smal mångspeglande kontaktremsa. I plastfallet [höger]
finns ingen sådan övergång: Adhesionen mellan vattnet och kärlväggen är
tydligen minimal i plastfallet — medan den i glasfallet är påtaglig.
Adhesionen, glasfallet [vänster] visar att vattnet »flyter upp» en liten bit
ovanför själva vattenytan mot kärlväggen; Vattenatomerna visar tydlig
benägenhet att förena sig med materialet.
övergång. Övergången i glasfallet syns som en
ganska precis 3 mM smal mångspeglande kontaktremsa. I plastfallet [höger]
finns ingen sådan övergång: Adhesionen mellan vattnet och kärlväggen är
tydligen minimal i plastfallet — medan den i glasfallet är påtaglig.
Adhesionen, glasfallet [vänster] visar att vattnet »flyter upp» en liten bit
ovanför själva vattenytan mot kärlväggen; Vattenatomerna visar tydlig
benägenhet att förena sig med materialet.
![]()

![]()
Kohesion, praktiskt köksexempel.
Bilden
ovan visar ett antal vattendroppar som sammanförts med olika material. Den
buktiga (konvexa ![]()
![]() )
droppformen är påtaglig i samtliga fall (utom med vattendroppen i motoroljan,
den bara sjönk ner). Emellertid är rundningen speciellt tydlig i fallet med
plast (plexiglas) och metall som underlag
)
droppformen är påtaglig i samtliga fall (utom med vattendroppen i motoroljan,
den bara sjönk ner). Emellertid är rundningen speciellt tydlig i fallet med
plast (plexiglas) och metall som underlag ![]() : ju
större rundhet i droppformens överdel, desto mera påtaglig är tydligen den inre
sammanhållande kraften, kohesionen, mellan partiklarna. En svag dropprundning
: ju
större rundhet i droppformens överdel, desto mera påtaglig är tydligen den inre
sammanhållande kraften, kohesionen, mellan partiklarna. En svag dropprundning ![]() kan alltså tolkas som att kohesionskraften
inuti vattenmaterialet i förhållande till adhesionskraften mot underlaget är
liten; En stor rundning betyder då att adhesionskraften är liten med en allt
mer påtagligt synlig inre sammandragande kraft, kohesionskraften.
kan alltså tolkas som att kohesionskraften
inuti vattenmaterialet i förhållande till adhesionskraften mot underlaget är
liten; En stor rundning betyder då att adhesionskraften är liten med en allt
mer påtagligt synlig inre sammandragande kraft, kohesionskraften.
Ett
materials SAMMANHÅLLANDE KRAFT kallas i allmänhet för kohesionskraft;
Kraft
som — utom gravitationen — strävar att förena olika material kallas i allmänhet
för adhesionskraft.
Sammanhållningen
inom materialet kallas kohesion, attraktionen mellan de åtskilda
materialen kallas adhesion.
PrimärKohesionen —
medelmaterialkraften mellan två medelatomer
I
exemplet med Vätebindningen H—H visas hur den primärt sammanhållande kraften mellan två
närliggande atomer [f.ö. och här veterligt den allra starkaste bindningen som
finns i fysiken, se Tabelldata] kan uttryckas på en relativt enkel, elementär
matematisk form som ansluter till ELEKTRISKA KRAFTLAGEN, se Kovalenta
bindningens allmänna form.
I det sambandets förlängning visas hur
också andra atomparföreningar, här främst grundämnesmetallerna, kan förstås med
hyfsad approximativ godhet mot uppmätta hållfasthetsvärden. Se resultatbilden i
Diagram Rm2
från ursprunget i Kovalenta bindningens
energiform.
Sambandsformernas enkelhet är alldeles
tveklöst en god hjälp i varje översiktlig orientering som berör kunskaper om
materiefysiken med hållfasthetslärans elementa — och som annars [vanligen i MAC] gömmer sig bakom
komplicerade avhandlingar på ingenjörsnivå.
Vilken är orsaken till att t.ex. en vattenyta uppvisar en tydlig
benägenhet att förena sig med en hård glasyta? Borde inte ytorna i själva
verket fullkomligt strunta i varandras inre domäner och bara fungera som helt
isolerade, neutrala, komponenter?
I MAC: vakuumets nollenergi.
I TNED: elektronmassans komponenter.
I
strängt ideal mening borde ingen som helst attraktiv fenomenkraft föreligga
mellan två olika material, frånsett gravitationens inverkan och förutsatt att
materialytorna är helt elektriskt oladdade. Men som just de enkla
köksobservationerna visar, beter sig materialen ingalunda alltid så, inte ens i
den uppenbart synliga sinnevärlden. Vilken är den rent kvalitativa
förklaringen?
I
modern akademi uteslöt man från år 1927 [Se citat från Gamow] den enda logiska möjligheten med elektronmassans
komponenter, en elektronmassans struktur — utan tanke på konsekvenserna.
För att kunna förklara KRAFTVERKAN i adhesionsfenomenet fanns alltså inget
annat för pionjären Hendrik
Casimir att välja på omkring året
1947 i fenomenets uppmärksammande än ”vakuumets nollenergi”, se SAMBANDSMATEMATIKEN
TILL VAKUUMETS NOLLENERGI i separat citatblock.
I TNED är det
just elektronmassans
komponenter som står för hela
föreställningen: Alla materialytor uppvisar utåt sett en toppyta med
elektronmassor. Inom vissa närgränser, när två material närmas varandra i mikro
och nanoområdet, finns ingen möjlighet för respektive materialyta att »låsa
sina» elektronkomponenter till »det egna materialet» — ungefär som att försöka
hindra en skock galet glada barn och älsklingshusdjur från att hälsa på
varandra efter en lång bortovaro och försöka intala dem att »uppföra sig
städat»: de försvinner in i varandras mängd, och det är bara den omfamnande
glädjen som räknas. De yttersta elementen i elektronmassorna kommer
urskillningslöst att identifiera sig med varandras materialmotsatta
atomföräldrar, alltmera ju närmare materialytorna kommer varandra — förstadiet
till reguljär kemisk förening. Därmed TNED-Casimir-sambandet, se utförligt från
INLEDNING
TILL CASIMIRSAMBANDET I RELATERAD FYSIK — eller direkt för jämförelse MAC-Casimir-beskrivningen.
Nedan
följer en mera utförlig genomgång av de mest uppenbara grunderna som berör
materialens hållfasthet i den relaterbara fysikens perspektiv — och hur vi
(möjligen) kan utföra relativt enkla överslagsberäkningar för att få tag på
praktiska värden.
VAN DER
WAALS KRAFTER — inledning · van der Waals, efter (1873) holländaren Johannes
Diderik van der Waals (1837-1923)

BILDKÄLLA:
Författarens arkiv · BildR78 Excur9 · 2okt2010 · Nikon D90 · Detalj
Brotthållfasthet · Grundläggande begrepp inom materialläran — Om
materialens sammanhållande krafter — Elektronen och elektronmassans
komponenter, Kohesion och Adhesion, Kraft och Energi
KORT SNABBGENOMGÅNG AV BEGREPPSGRUNDERNA i Materialläran OCH Hållfasthetsläran
————————————————————————————————————————————————————————————————————————————————————————
Hållfasthet
för material [eng. strength, firmness] är ett grundläggande tekniskt
[test-]begrepp som sammanhänger med all form av konstruktion, byggnad och
materialanalys. Ett materials hållfasthet bestäms generellt [förenklat] av den
kraft, tryck eller belastning som krävs för att påvisa ett brott i materialet,
den s.k. brottgränsen [Rm] [eng. Ultimate Strength].
Därmed termen eller begreppet brotthållfasthet. De olika termer som
förekommer visas i grundformen med belastningsdiagrammet, där ges också en del
webbreferenser i ämnet.
2010X7
Casimireffekten — från allmän hållfasthetslära
Universums
Historia — BellDHARMA 2010
Frånsett
atmosfäriska tryck, materialens egentyngder i givna gravitationsfält (g-fält),
materialens inbördes attraherande g-krafter och elementarladdningens inre struktur: Idealt mellan två idealt plana, elektriskt oladdade,
parallella materialytor åtskilda av planavståndet (d) finns ingen
KRAFTASPEKT:
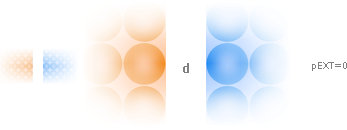
Frånsett
gravitationen: Ingen kraftverkan föreligger mellan två oladdade materialytor.
Med
noll planavstånd är — följaktligen — också KRAFTASPEKTEN noll:
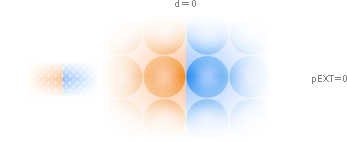
Ingen
kraftverkan föreligger mellan två närliggande atomplan — förrän man försöker
pressa ihop eller [för ett givet, redan sammansatt material] dra ifrån.
Man
kan — idealt — skilja och återförena materialytorna hur många gånger som helst
— utan inblandning av några extra krafter utöver de som behövs för att flytta
materialmassorna som enskilda fristående massobjekt.
I den
ideala modellen kan vi också påverka materialföreningsgränsen vid ideala d=0
genom att påföra materialen extra yttre tryckkrafter.

Varje
intryckande extra kraft som läggs på de bägge materialdelarna medför, på ett
eller annat sätt, en DEFORMATION i materialet (idealt från föreningspunkten d=0
och vidare inåt). Deformationen blir bestående om kraften [p(EXT)]
överskrider materialets elasticitet (Re).
Under den gränsen återtar materialet sin ursprungsform då deformationskraften
tas bort och alltmer exakt med allt mindre p(EXT). Med en viss lägsta
deformationskraft kan materialdelarna ingå beständig förening, s.k. kallfogning
(eng. Cold Pressure Welding), eller kall(press-)sammanfogning
(’kallpress-svetsning’). Villkoret (som vi förstår) är att den intryckande
kraften måste överstiga (minst 5-10 ggr) den naturligt sammanhållande (elastiska) kraften i
materialets närliggande sammanhållande atomskikt. Den överskjutande delen
garanterar arbetet för den permanenta låsningen.
Vi
backar tillbaka till situationen med d=0, Bild 2: ![]()
I DEN PRAKTISKA FYSIKEN är det inte (riktigt) så enkelt (som vi
redan vet).
Idealt
närliggande (plana) materialytor, som i Bild 2 [rundlarna föreställer varje atoms idealt avgränsade
sfäriska domän], är definitivt INTE alls enkla att »plocka isär» genom några
»ideala plansnitt» mellan närliggande atomplan. Att skapa en mellanliggande fri
distans (d) — ett brott — generellt mellan närliggande atomplan i
ett godtyckligt [fast] material, kräver i allmänhet mycket stora dragkrafter.
Det är den ena sidan av saken.
Den
andra sidan av saken är att — och här saknas [‡] teorin generellt i MAC, men inte i TNED [‡]— materialgränserna, ovan som ideala plan som stryker
exakt utmed medelatomavståndens sfärgränser, inte har den ideala
beskaffenheten: Atomens yttersta delar, i formen av elektronmassorna, närmare
bestämt genom elektronmassans
komponenter, besitter [delvis
beroende på material] relativt stor frihet att »koka» upp, utöver, utanför
den ideala plangränsen för atommedelavstånden — och därmed associera sig
med närliggande materials atomdomäner [Elektronelementens kärnattraktioner skymmer varandra
periodvis på grund av de inbördes rörelseformerna så att elementen periodvis
framstår som frikopplade från sin atomära materialdel — och därmed
tillgänglighet för andra materialdelar].
Vilket vill säga: Elektronmassornas yttersta delar och inom vissa små
näravstånd kan dela varandras atomdomäner — i princip oberoende av
materialoriginal. Med andra ord: närliggande materialytor kan attraheras
— elektriskt.
Utan en struktur för elementarladdningen (elektronen)
blir en sådan förklaring omöjlig.
I TNED utgör atommedelavståndet (kortaste, kubiska) den absoluta närgränsen för en sådan intern
materialattraktion — vilket motsvarar situationen i Bild 2.
Närmare än så kan två idealt plana materialytor inte komma varandra genom
ömsesidig elektrisk attraktion om de förs ihop från situationen i Bild 1, d>0.
Attraktionskraften i det läget får för teorins del
heller inte vara större, eller ens tangera, materialets naturliga
hållfasthetsgräns (Brottgränsen [Rm]) [eg., heller inte ens FLYTGRÄNSEN (sträckgränsen, [Re])].
För att uppnå ämnets naturliga hållfasthet, måste (nämligen — och vilket utesluter MAC-Casimirsambandet som relevant för hållfasthetsfysikens
kända domäner, kurvbilden nedan) en
ytterligare (materialdeformerande) intryckning ske typ Bild 3.
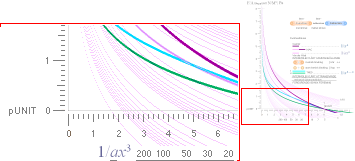
Jämförande
funktionsgrafer MAC-TNED
Jämförande funktionsgrafer MAC-TNED för Casimirsambandets fysik
—————————————————————————————————————————————————
EXEMPEL MED SEGJÄRN SIS 07 17-02 — beräkningsdata från Kalkylkortet
GrafUnit50 y=(ln[(x'–2)([x'm]'–2)])/(ln10); MAC(m)=1; TNED(m)=x/[a=1|1000]
————————————————————————————————————————————
Grafisk
form — se även TNED-Casimirsambandet i separat dokument:
y
= x–2[(x)m]–2 — Casimireffekten typfunktionen ovan
renodlad som nedan
m
= 1
........................ motsvarar
MAC-formen med d 4 ljusvioletta grafen
m
= x/a ..................... motsvarar TNED-formen med
separerade typ d1 2d2 2 ; n=n/4 ; ljusblå | gröna graferna markerade 1 | ∞
————————————————————————————————————————————
För jämförelsen har använts [rumstempererat]
Järn [26Fe58] från Kalkylkortet med materialparametrar för motsvarande
SEGJÄRN enligt
MATERIALLÄRA (Karleboserien 5 1980 s205 Tabell
7.2 Segjärn [SIS 07 17-02]:
Brottgräns [Rm] 400 MPa, Resttöjningsgräns
[Rp0,2 — strax under materialets sträck- eller flytgräns, Re] 250 MPa.
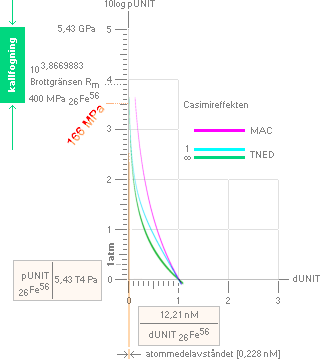
166 MPa-värdet är TNED-Casimirsambandets värde för
materialytornas attraktionstryck vid deras exakt ideala nollavstånd, analogt
uppnått atommedelavstånd utan ytterligare. Notera att det värdet [i detta fall]
gränsar till den s.k. Resttöjningsgränsen Rpn (för segjärn min.
220-250 MPa) som i sig ligger strax under elastiska deformationsgränsen [Re],
se referensdata i Grundläggande hållfasthetsbegrepp.
MAC-sambandet till jämförelse ger inga
materialparametrar. För TNED-gränserna 1
| ∞, se utförligt i TNED-Casimirsambandet.
KALLFOGNINGSSTAPELN [grön, bilden ovan], dess
nedre kant, motsvarar TNED-Casimirsambandets tangerade
atommedelavstånd — i Järnexemplet ca 166 MPa för den naturligt
attraherande närverkan via TNED-Casimirsambandet. Från denna punkt och
vidare uppåt måste en extra intryckande-deformerande kraft adderas [5-10 ggr Re-värdet] för att få
atomföreningarna att uppvisa ett naturligt motsvarande sammanfogande
hållfasthetsvärde för de förenade tryckytorna. Figuren nedan illustrerar hur
den intryckningen måste göras med internt penetrerande atomdomäner, [som efter
materialets interna fördelning etablerar] analogt bestående deformationer [minst 40%].
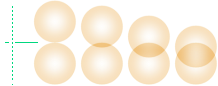
Kallfogningsinpressning
— extra kraft krävs för att nå Rm-hållfasthet i fogen.
MAC-Casimirsambandet klarar inte den biten.
Den ljusvioletta grafdelen [grafbilden ovan] i MAC-sambandet tangerar brottgränsvärdet (Rm) redan långt innan
materialytornas separationsavstånd når atommedelavståndet. Medan således TNED-Casimirsambandet uppvisar en
kontinuerlig, relevant och till synes rationell materialbeskrivning ända in
till atommedelavståndet, samt i tydlig respekt till de redan kända allmänna
hållfasthetsdomänerna, finns ingen liknande aspekt att rapportera i fallet MAC-sambandet.
Grafen nedan samma som ovan men förlängd i
horisontalled [x] för större tydlighet:
Exemplet med Segjärn SIS 17 07-02
—————————————————————————————————————
▬▬ GrafUnit50 yTNED = [(ln[([x/5]'–2)([(x/5)'[x/5]/1000]'–2)])/ln10]
▬▬ GrafUnit50 yMAC =
[(ln[([x/5]'–2)([(x/5)'1]'–2)])/ln10]
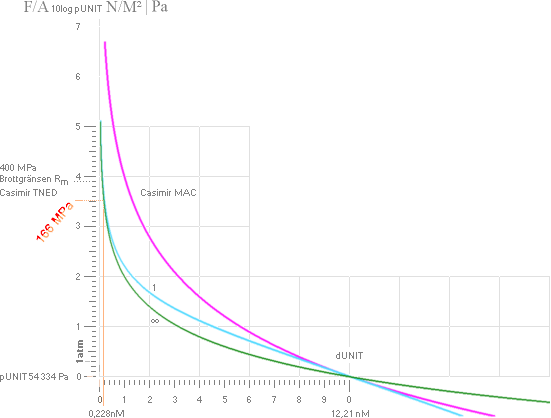
— Exemplet klargör speciellt att Casimir
MAC-sambandets form tydligen och omöjligen kan koppla praktiskt till någon
begriplig hållfasthetsfysik eftersom materialets brotthållfasthetsgräns enligt
den kurvan [ljusvioletta ovan] uppnås märkbart långt innan atommedelavståndet
d0 [inte bara i Järnexemplets fall] uppnås.
— Däremot matchar TNED-formen
hållfasthetsvärdet utomordentligt — LÄGRE Rm-värde VID d0 [0,228 nM i
exempelfallet].
Alla
resultatvärden i Kalkylkortet.
— För att matcha materialhållfastheterna
rimligt [i intervallet 0,1-20 nM], måste MAC »hitta något annat samband»: Man använder
sambandsformen för van der Waalskrafterna [Se Övergången vdW-Casimir] — men inte heller då
stämmer det riktigt bra ... Vidare i huvudtexten.
Vad vet man rent tekniskt om hur värdebilden (insinuerad ovan)
stämmer i området molekylära attraktionskrafter?
Det tråkiga är vid genomsökning på webben
[bland hundratals forskningsrapporter, Okt2010] att inga begripligt klara
referenser till jämförelse alls verkar finnas — »helbildsgrafer» typ 0,1-1000
nM verkar inte finnas, inte för något enda provmaterial. [Det liknar mest
situationen då havregrynsgröten befinner sig i kokning, långt ifrån tillfället
då den lugnat ner sig för servering till frukost]: forskning pågår.
I
sektionen Casimircitat ges referenser till en del av det utbud som finns gratis
tillgängligt på webben.
De mätdata som finns där ansluter
emellertid specifikt till ’Casimirområdet’ grovt (10-20)nM-100µM, medan vår
fråga ovan snarare har fokus på området 0,1nM-(10-20)nM — och som vi redan vet
ligger utom ramen för det etablerade Casimirsambandets räckvidd. Se den
ljusvioletta grafdelen ovan. Vi skulle vilja ha jämförande mekaniska mätdata
på just närområdet 0,1nM-(10-20)nM — med preferens utifrån och in, alltså från
10nM och inåt.
Här veterligt: det finns inga sådana
undersökningar [ännu Okt2010] som kan förstås på någon begriplig nivå — Eller så finns det, men inbäddat i den moderna
akademins komplicerade kemiska vokabulär — som i princip är omöjligt att hitta
utom för den som inte redan är insatt.
Det
enda referensmedel som framkommit visas i Jämförelse
med Sandia National Laboratories
— och det är bara en delvis indikation då källan inte närmare specificerar
ämnessammansättningen, eller ens koefficienternas värden.
Förhoppningen är att det kommer fram ett
bättre uppgiftsunderlag inom den närmaste framtiden — nanoforskningen är
generellt intressant ur flera synvinklar och står helt säkert i
experimentalfysikens fokus för lång tid framöver.
För
den vidare orienteringen, se även i
GRUNDLÄGGANDE
OKLARHETER i den grundläggande materialbeskrivningen I MODERN AKADEMI.
Se
även i
TNED-Casimirvärden gränsar till materialens brottgräns
— medan däremot MAC-sambandet skjuter över målet med
stora belopp
— Hur MAC beskriver typglappet 0,1-10nM
BILDKÄLLA
ovan: Författarens arkiv · Bild219 R2010APR13 · Nikon D90 · Detalj · BILDKÄLLA
nedan: Författarens arkiv · Bild11Skruv · 4nov2010 · Nikon D90
Materiallära — grundläggande hållfasthetsbegrepp
GRUNDLÄGGANDE HÅLLFASTHETSBEGREPP är den ENERGI och KRAFT som sammanhåller
länkarna — atomerna — i ett material. Till dessa hör sedan speciella
facktermer, benämningar och begrepp av typen KJ/mol, Kovalent Bindning, van der Waals Krafter [Hamakerkonstanten, m.fl.]. Avsnittet nedan
genomgår grunderna — och försöker reda ut de krångliga kopplingarna.
De allra starkaste MATERIELLA bindningarna
mellan olika atomer är inte som vi vanliga amatörer kanske kan tro, typ METALLER
och DIAMANT. Det är — faktiskt — ORGANISKA MOLEKYLER [‡org]. Skillnaden är också
jättestor [‡met]. Exempel följer.
ENERGIINNEHÅLLET PER KUBIKMETER ![]() MATERIAL av ett material
är alltid lika med DEN MATERIALSAMMANHÅLLANDE KRAFTEN [F] ÖVER tvärsnittsYTAN
MATERIAL av ett material
är alltid lika med DEN MATERIALSAMMANHÅLLANDE KRAFTEN [F] ÖVER tvärsnittsYTAN ![]()
![]() [A]:
[A]:
F/A =
N/M² ........................ över ytan
.................... kraft, N
=
NM/M³ ..................... över volymen .............. energi,
J=NM
=
J/M³
=
E/V
=
Rm ........................... N/M² = Pa
=
materialets brottgräns [Rm]
I konventionell facklitteratur används ofta
enheten ”kJ/mol”, »KiloJoule/GRAMmol», KJ/GRAMmol med
1 GRAMmol = ”1 mol” = 1/[1000u] = 0,001 KGmol
= AVOGADROS TAL avr. 6,023 T23 = ”1mol” ;
— Förklaring: Antalet [N] atomer eller molekyler med massan m KG av ett ämne
är N=m/Uu, U medelatomvikten och u atomära massenheten; sätt m=U gram av ämnet,
och man får N=U(0,001)KG/Uu=1/1000u: Antalet N atomer (eller molekyler) i ämnet
ges som 1 GRAMmol = 1/1000u = 6,023 T23 st enheter =
AVOGADROS TAL atomer eller molekyler som är lika stor grammängd av materialet
som dess medelatomvikt U — eller ALLTID per 6,023 T23 stycken individer atomer
eller molekyler:
— PER mol är alltså helt
enkelt »per U gram av ämnet».
Se även FOCUS MATERIEN 1975 s156sp1ö:
”En mol av ett ämne är så många gram av ämnet
som den sammanlagda atomvikten anger.”.
KJ/GRAMmol = (1000 J)/[1/u · 1/1000]
=
MJ·u ........... J
Värdetalet i KiloJoule (via begreppet ”mol”)
omformas till samma värdetal men i MegaJoule (via multiplikation med u);
=
1000 J · 1000u
=
KJ · 1/mol
KJ-värdet — underförstått i ”mol” är samma som
MJ-värdet — underförstått i produkt med u.
Jämför: 2,85 KJ (”per
mol”) = 2,85 MJ (gånger u).
Antalet (N) medelatomer i V = 1 M³ av
materialet med massan m är N=m/Uu=ρV/Uu med
m = ρV,
ρ materialets medeltäthet i KG/M³,
V = 1M³,
U medelatomvikten och
u atomära massenheten [här 1,66033 t27 KG]. Energin för alla N
medelatomer i 1 M³ av materialet blir alltså
MJ·u·N =
MJ·u·ρV/Uu
=
MJ·ρV/U
=
E ................. MJ
E =
MJ·ρV/U ;
E/V =
MJ·ρ/U ........ J/M³ = N/M² = Pa
=
F/A
=
Rm ............. MPa ;
Rm =
MJ·ρ/U ....... MPa
Värdetalet i MegaJoule (MJ via multiplikation med
u) är samma som värdetalet i KiloJoule (KJ med
underförstådd association till den moderna akademins i särklass allra mest
ologiska begrepp ”mol”, som ovan):
=
KJ/mol·ρ/U ;
KJ/mol =
Rm·U/ρ ........ Rm i MegaPascal
;
Rm =
KJ/mol·ρ/U ... MPa
Jämförande
tabeller — Kovalenta bindningar
Engelska Wikipedia innehåller en tabell (på
underrubriken Strong chemical bonds) på artikeln Chemical bond (2010-10-28) med
några fundamentala kemiska bindningar uttryckta i KJ/mol. För att få en
uppfattning om den motsvarande MATERIALSTYRKAN, sambanden ovan, har
KJ/Mol-värdena här kompletterats med Rm-värden i MPa.
KO[ömsesidigt]VALENT[tillämplig]
Kompletterande grundtabell — materialstyrkan
hos grundmolekylerna
Kovalent
bindningsform — Wikipediakällan (ovan) utsäger inte det (2010-10-31), och ger
heller ingen teckenförklaring till beteckningssätten, se separat tabell nedan.
Kovalent
bindning: de kemiskt förenade atomerna delar på ett (uni[–] eller mono), två (di[=]) eller tre (tripel[≡] eller tri) par elektroner.
Jonbindning: minimal
elektrondelning.
Se även Särskild
illustration till Vätebindningen H—H.
Kovalenta
bindningsformen — kemiskt beteckningssätt med valensstreck med namn: EX: N≡N betecknar en tri-kovalent bindning mellan
Kväve-Kväve, även benämnd ’trippelbindning’ [KÄLLA: FOCUS MATERIEN 1975 s155ö,
s156sp2];
|
beteckning |
– |
= |
≡ |
|
namn |
uni- |
di- |
tri- |
|
|
singulär |
dubbel |
tripel |
|
medelatomvikt |
typ |
kemisk bindning |
d0, längd pM |
E, KJ/mol |
Rm, GPa |
ρ |
|
U |
|
Vätebindningar |
t12 M |
MJ·u |
T9 N/M² |
KG/M³ |
|
Väte-Väte |
H–H |
74 |
436 |
1786,43 |
4 097,31 |
|
|
8,5 |
Väte-Syre |
H–O |
96 |
366 |
686,85 |
15 951,43 |
|
10 |
Väte-Fluor |
H–F |
92 |
568 |
1211,10 |
21 322,15 |
|
18 |
Väte-Klor |
H–Cl |
127 |
432 |
350,16 |
14 590,02 |
|
|
|
Kolbindningar |
|
|
|
|
|
6,5 |
Kol-Väte |
C–H |
109 |
413 |
529,50 |
8 333,52 |
|
12 |
Kol-Kol |
C–C |
154 |
348 |
158,20 |
5 455,24 |
|
12 |
Kol-Kol |
C=C |
134 |
614 |
423,69 |
8 280,59 |
|
12 |
Kol-Kol |
C≡C |
120 |
839 |
806,14 |
11 530,07 |
|
13 |
Kol-Kväve |
C–N |
147 |
308 |
160,99 |
6 794,94 |
|
14 |
Kol-Syre |
C–O |
143 |
360 |
204,40 |
7 949,03 |
|
15,5 |
Kol-Fluor |
C–F |
134 |
488 |
336,74 |
10 695,76 |
|
23,5 |
Kol-Klor |
C–Cl |
177 |
330 |
98,81 |
7 036,27 |
|
|
|
Kvävebindningar |
|
|
|
|
|
7,5 |
Kväve-Väte |
N–H |
101 |
391 |
630,10 |
12 086,25 |
|
14 |
Kväve-Kväve |
N–N |
145 |
170 |
92,58 |
7 624,62 |
|
Kväve-Kväve |
N≡N |
110 |
945 |
1178,82 |
17 464,03 |
|
|
|
|
Syrebindningar |
|
|
|
|
|
16 |
Syre-Syre |
O–O |
148 |
145 |
74,26 |
8 194,63 |
|
16 |
Syre-Syre |
O=O |
121 |
498 |
466,73 |
14 995,41 |
|
|
|
Halogenbindningar |
|
|
|
|
|
19 |
Fluor-Fluor |
F–F |
142 |
158 |
91,62 |
11 017,5 |
|
35 |
Klor-Klor |
Cl–Cl |
199 |
243 |
51,20 |
7 374,00 |
|
40,5 |
Brom-Väte |
Br–H |
141 |
366 |
216,78 |
23 987,89 |
|
80 |
Brom-Brom |
Br–Br |
228 |
193 |
27,04 |
11 206,75 |
|
63,5 |
Jod-Väte |
I–H |
161 |
298 |
118,56 |
25 263,33 |
|
126 |
Jod-Jod |
I–I |
267 |
151 |
13,17 |
10 990,85 |
TABELLFÖRKLARINGAR med källreferenser:
Bindningslängden
d0 i picoMeter, ”In molecular geometry, bond length or bond distance
is the average distance between
nuclei of two bonded atoms in a molecule.”, @INTERNET Wikipedia
Bond length 2010-10-28;
Bindningsenergin
E i KJ/mol, grunddata, se sist
nedan;
Materialstyrkan
Rm i GigaPascal, efter medelkubvolymen d0³ och medelatomvikten Uu med
medeltätheten uU/d0³,
Rm = KJ/mol·u/d0³/1000, GPa [Se
särskild HÄRLEDNING];
Medeltätheten
ρ i KG/M³, efter atommedelavståndet d0 lika med bindningslängden
som ovan, ρ = uU/d0³ med
medelatomvikten
U som
(U1+U2)/2, U12 bägge avrundade heltal (från särskild tabell i PERIODISKA
SYSTEMET).
........... högsta kolumnvärdet
KÄLLDATA — utom
U, Rm och ρ: @INTERNET Wikipedia Chemical bond 2010-10-28
[Wikikällan från University of Waterloo,
Cyberspace Chemistry — begränsad behörighet].
Jämför motsvarande materialstyrka för några av
metallerna
[se Tabell med källdata i Kalkylkortet, Tabellflik1
Ämnestabell]:
|
bet. |
ämne |
Z |
U |
ρ(KG/M³) |
|
d0 pM |
Rm|GPa |
|
|
Al |
Aluminium |
13 |
27 |
2700 |
|
255 |
0,65-1,5 |
0,065-0,150 |
|
Cr |
Krom |
24 |
52 |
7190 |
|
229 |
2,99 |
0,413 |
|
Fe |
Järn |
26 |
56 |
7870 |
|
228 |
2,85 |
0,400 |
|
Co |
Kobolt |
27 |
59 |
8900 |
|
222 |
— |
— |
|
Ni |
Nickel |
28 |
59 |
8910 |
|
222 |
0,3-2,1 |
0,045-0,317 |
|
Cu |
Koppar |
29 |
64 |
8930 |
|
228 |
1,43-3,23 |
0,200-0,450 |
|
Au |
Guld |
79 |
196 |
19260 |
|
257 |
1,22 |
0,120 |
KJ/mol = Rm·U/ρ ........ Rm i MegaPascal
Jämförande
karaktäristik:
1. medelatomavstånden är runt dubbelt så långa
för metallerna jämfört med organiska grundmolekylerna;
2. materialstyrkan hos metallerna är runt 1
000 ggr lägre (400/0,4 = 1 000) jämfört med organiska grundmolekylerna;
3. metallerna uppvisar tunga atomkärnor med
elektronmassor längre ut jämfört med de lättare organiska grundmolekylerna;
Olika sätt kopplar olika styrka
Grundbegreppen
från MAC:
”Kovalent bindning I en renodlad jonbindning är varje elektron
lokaliserad till en bestämd atom. Är elektronmolnens yttre delar gemensamma
innebär det att några av
elektronerna inte tillhör en utan flera atomers elektronmoln. De har blivit delokaliserade. Den bindning som
då uppkommer kallas kovalent
bindning eller elektronparsbindning.”,
”En
kovalent bindning kan sträcka sig över många atomer. Så är t.ex. fallet i
metallkristaller. Metallisk
bindning är därför ett specialfall av den kovalenta.”,
”Mellan
kovalent bindning och jonbindning finns alla övergångar. Ju mer lokaliserade
elektronerna är desto större är jonbindningsinslaget, medan det kovalenta
inslaget ökar med ökad delokalisering.”,
”Övriga
bindningar Andra slag
av kemisk bindning är mycket svagare än
jonbindning och kovalent
bindning. Dipolbindning, vätebindning och van
der Waalskrafter är de viktigaste.”
FOCUS
MATERIEN 1975 s149sp2n-s150sp1ö
I den diversitet av olika möjliga resonanser i elektronmassorna som kan finnas i den kemiska kopplingen
mellan två närliggande atomer, finns en motsvarande stor mängd olika sätt som
den atomära bindningen kan verkställas på.
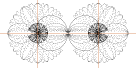
Typmönster i centralkraftsverkan — PREFIXxSIN 1+sinax a(1—10) 1tUnit30
Bindningen mellan atomernas positivt laddade
atomkärnor återfaller helt på den mellanliggande negativt laddade
elektronmassan och dess förmåga att sammandra kärnorna.
![]()
Bilden ovan illustrerar i TYPFORM två atomer
som hålls samman av en deras gemensamt mellanliggande elektronmassa, här
idealiserad som en samlad sfärisk kropp (blå). I praktiken ligger
elektronmassan utspridd på olika mer eller mindre utspridda lokaler med
[inbördes komplicerade] resonansmönster och olika fördelning i olika partier av
xyz-rymden.
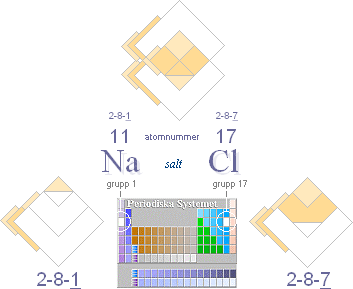
— Det som atomerna MEST tycks intressera sig
för är RESONANSKRITERIET (harmoniska symfonier): helt ÖMSESIDIGT fyllda
resonansskal — typ NaCl [se även i PERIODISKA
SYSTEMET]:
— Om två (ELLER FLERA) atomer SUMMERAR en
oktett [8-tal] — fylld resonans — i atomens yttersta delar, har atombindningen
den allra största förutsättningen för att bli maximalt stark.
Som redan påpekats i PERIODISKA
SYSTEMET betyder det att speciellt atomer i ändgrupperna 1 och 17, t.ex.
NaCl [figuren ovan i sammanställt »kemiskt percept»], representerar särskilt
starka bindningar.
Men även mera exotiska typer med »fyllda
resonanser» kan förekomma. Ett exempel är två Kväveatomer [N{2-5}-N{2-5}]: De tre elektroner som fattas
i ytterelektronskalet för fylld resonans kan delas av N-N-kopplingen genom att
endera N-atomen LÅNAR UT 3e till den andra: Resultatet kallas konventionellt en
Tri[pel]Kovalent Bindning, »TRE par elektroner» delas mellan två atomer.
Den tri[pel]kovalenta bindningen är en av de allra starkaste molekylbindningar
som finns, se N≡N i föregående jämförande
tabell.
Starkaste bindningen
mellan två närliggande atomkärnor med samma laddningspolaritet ges naturligtvis
främst OM de repulsiva kärnpotentialerna SKYMS NER av en mellanliggande motsatt
potential — en mellanliggande elektronmassa. Vätebindningen H—H
är tydligen den ideala hörnstenen i den principen [dessutom tydligen också
den starkaste]: Med en och samma laddningsrepresentation,
enbart med ändring av atommedelavstånden (d0) och KRAFTDÄMPNING med (1/Zatomnummer) motsvarande
kärnrepulsionernas växande inslag med växande Z, ges en tydligt hyfsad
representation 0-1000 MPa för samtliga grundämnesmetaller, se Diagram
Rm3, Diagram Rm2 och Diagram Rm1.
Exempel på Webbkälla som refererar ovannämnda
detaljer:
Tripel-Kovalent Bindning [Med exemplet
Kväve(N)-Kväve(N) enligt N≡N]
http://www.tutorvista.com/content/chemistry/chemistry-i/chemical-bonding/triple-covalent-bond.php
Allmänt etablerade begrepp — exempel på hur
termerna används:
TRIVALENT bindning, TREatomBindning
DIVALENT bindning, TVÅatombindning (di-atomär
bindning)
KOVALENT bindning,
PARELEKTRONDELNINGS-Bindning — som kan vara singulär (1), binär (2), triplär
(3), teträr (4), pentär [5], osv.
Kovalenta
bindningen delar på ETT PAR ELEKTRONER för varje kovalens:
EX: En bindning mellan två atomer kan dela på
TRE PAR elektroner, TRE kovalenser, vilket blir en TriplärKovalent Bindning
eller en TripelKovalent Bindning.
Webbkällor verkar i allmänhet dåliga på att
ange KVANTITATIVA VÄRDEN för påstådda olika bindningstyper.
Här finns en upphittad som
skiljer sig:
PROPERTIES
AND ENERGY CONTENTS OF CHEMICAL BONDS — Peter v. Sengbusch 2003
http://www.biologie.uni-hamburg.de/b-online/e18/18c.htm
”Covalent bonds are the most important type of bond occurring in organic
molecules. They are characterized by a common
pair of electrons between two neighbouring
atoms. Depending on the involved partners, simple, double or triple
bonds can be formed (H–H, O=O, N≡N).”
:
delta G of a covalent bond -210 to
-420 KJ/mol
Weak interactions -4 to -30
KJ/mol
Thermal molecular movements -0,7 to -3 KJ/mol
delta G of Ionic interactions -20 to -30 KJ/mol
Van der Waals attraction -3 to
-4 KJ/mol
Källan ovan ger dock ingen förklaring till
”delta G” — man får söka svaret på annat håll. En annan källa upplyser
”Delta G Energy
can be used to do work. Scientists call this useful kind of energy "free energy" and represent it with the letter "G"
(named after the scientist Josiah Willard Gibbs, who first thought of this
concept).”,
BIOdotEDU
— Bond Energy 2005
http://www.brooklyn.cuny.edu/bc/ahp/LAD/C4d/C4d_bondenergy.html
EXEMPLEN VISAR ORDNINGEN.
Ytterligare en upphittad källa som anger
referensvärden för de olika kemiska bindningskrafterna — notera differenserna
mot föregående, samt även i jämförelse med energiinnehållet i motsvarande
metalliska bindningar [Se tabellen i Jämförande metallbindningar]:
TABLE 3.1 Bonding energies for various atomic
bonding mechanisms
Bonding mechanism Bonding energy [kJ·mol^-1]
Ionic 340-800
Covalent 270-610
Metallic 20-240
Van der Waals <40
GOOGLEBÖCKER s27 Table 3.1,
UNDERSTANDING MATERIALS SCIENCE: history,
properties, applications — Rolf E. Hummel 2004
Tabellvärdet
närmast ovan för ’Metallic’ anger 20-240 KJ/mol — att jämföra med tabellhållfasthetsvärdets 0,65-2,99
KJ/mol för metallerna Al, Cr, Fe, Ni, Cu, Au i Jämförande metallbindningar.
Vi vet inte här om källförfattaren ovan
möjligen avser ytterst extremt speciella metallbindningar — typ superspeciella
legeringar med mycket höga brotthållfasthetsvärden, typ (240 KJ/mol)(8000
KG/M³)/26~73,8 GPa. MatWeb ger
som jämförande motvikt högsta brottgränsen (Rupture Strength) för Kolstål (High
Carbon Steel) 0,621-1,3 GPa, och för
rostfritt stål (Stainless Steel med Tensile Strength, Ultimate ) 0,085-3,00 GPa. Av allt att döma är det storleksordningen i varje fall
för de mest draghållfasta stålen — ännu långt från typ 70 GPa.
EXEMPLET BARA UNDERSTRYKER ORDNINGEN (här
färgat av min personliga erfarenhet i webbsökningen Okt2010): Mera av regel än
undantag är webbkällor på området — även böcker som ovan — knapphändigt
relaterade, inte sällan [som ovan] med inbördes rätt präktiga differenser.
Jämför även uppgiften från Wikipediatabellen på den trikovalenta N≡N-bindningen
med 945 KJ/mol, att
jämföra med bokexemplet ovan som anger max 610 KJ/mol för kovalent bindning. Det är tydligt [frånsett rent
tekniska orsaker i vetenskapshistoriens utveckling] mera längre ifrån än
närmare någon ambitiöst precisionsbaserad allmän lärostol. Skulle man använda
typ Soleffekten [3,8 T26 W] med samma typdifferens, vore vi nog (tillbaka) vid
år 1311.
[OM författarna hade en etablerad källa att
referera till, typ mätlaboratorium erkänt för noggrannhet och omsorgsfullhet,
skulle ovannämnda datatyp reduceras till ett minimum. Också det exemplet pekar
på det uppenbara: organisationen för rent vetenskapliga ändamål utan
vinstintressen inom forskningsvärlden är uppenbarligen inte optimal].
Örnnebulosan [detalj] — En av de magnifika stoft och gasöarna [i huvudsak VÄTGAS] i Universum som tros vara tummelplatsen för nybildning av
stjärnor.

Credit: Astronomy Picture of
the Day — National Optical Astronomy
Observatory/Association of Universities for Research in Astronomy/National
Science Foundation — 2009 February 8 — http://apod.nasa.gov/apod/ap090208.html
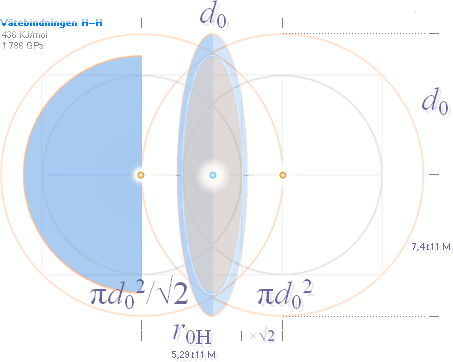
Vätebindningen H—H
Kovalenta bindningsgeometrins grund
Kohesionsfysikens enkla
grundsamband — exempel
Särskild illustration till Vätebindningen H—H
— den ekvivalent sammanhållande ytkraften — från Jämförande
tabeller — Kovalenta bindningar
OM vi prövar att beräkna Coulombkraften
[F=k(Q/d)²] på vanligt sätt enligt Elektriska
kraftlagen som nedan [Se särskilt block i Kalkylkortet Tabellflik 1 — Kontrollräkning |
Jämförande tabeller — Kovalenta bindningar | Väte] med distansvärdet d0=74 pM från Tabellen och med k=1/4πε0 ges resultatet som visas
underst i figuren nedan — enklast tänkbara geometriskt EKVIVALENTA
mönsterkoppling. Vi studerar — alldeles tydligt — en Hörnsten i Fysiken:
F/A = [2·k(e/[d0/2])2/πd02]·√2
=
[k(e/[d0])2/πd02]/√2
=
(ke2/π√2)/d04
=
1 731,29 GPa
Jämför tabellvärdet
= 1 786,43 GPa
Vätebindningens
grundgeometri,
se även Inledande beskrivning
Orangea
punkterna representerar de bägge väteatomernas kärncentrum. Den blå punkten i
mitten representerar den idealt gemensamma elektronladdningens sfäriska
punktlokal. Tvärsnittsytan i mitten, som begränsas av de orangea cirklarnas
skärningspunkt, är den som definierar elektriska kraftflödets cirkulärt
ekvivalenta tvärsnittsyta för det ekvivalenta atomattraktionstrycket [1731 GPa]
— den ekvivalent
sammanhållande ytkraften.
För att få tabellvärdet på 1786,43 GPa ska
d0 vara 73,422 pM med konstanterna enligt Kalkylkortet [Tabellflik 1].
Överensstämmelsen via √2 som transformationsfaktor
mellan de olika distanserna [Väteatomens grundradie eller Bohrradien Hr0 och d0
samt tvärsnittsytans reduktion] är inte »exakt» [vid rumstemperatur] — men som vi ser,
mycket nära [96,91% träff] — d0(74pM)/Hr0(52,9pM) är realt 1,398 mot idealt 1,414 [98,87% träff].
Med
den uppenbara resultatgeometrin frågar man sig då vad källuppgiften från
Wikipediakällan grundas på — för noggrannhetens skull.
Wikikällan refererar till ett University
of Waterloo med en Cyberspace Chemistry Home Page — med begränsad
behörighet för allmänheten. Källan upplyser [2010-11-04],
”Bondlengths are determined by X-ray
diffraction of solids, by electron diffraction, and by spectroscopic methods (study the
light absorbed or emitted by molecules).”,
”The bondlengths ranges from the shortest of 74 pm for H-H
to some 200 pm for large atoms, and the bond energies depends on bond order and
lengths.”,
University
of Waterloo — Cyberspace Chemistry — BOND
LENGTHS AND ENERGIES — datumuppgift saknas
http://www.science.uwaterloo.ca/~cchieh/cact/c120/bondel.html
OM
uppgiften på 74 pM (7,4 t11 M) kommer från spektroskopiska-röntgendiffraktiva
mätningar är det tydligt att överensstämmelsen med den enkla geometrin som ovan
är
1.
påtaglig,
2.
pålitlig — och därmed
3.
väl relaterbar.
VAD
VI HAR FÖRSTÅTT AV DEN SAMMANHÅLLANDE YTKRAFTENS FENOMENFORM,
——————— ———————
är
att dess distansform inte kan ändras (frånsett ytterst små fluktuationer) med
mer än att materialbindningen bryts, att det uppstår ett materialbrott — materialets
brotthållfasthet (Rm).
Vare sig vi försöker att ytterligare pressa
ihop komponenterna, eller att dra isär dem, uppvisas i vilket fall lika stora
inre motkrafter, samma som DEN SAMMANHÅLLANDE YTKRAFTEN, och som strävar att
bevara jämvikten
med nollspänning. Med andra ord: det
finns ingen (nämnvärd) töjbarhet i den sammanhållande ytkraftens
flödestvärsnitt hos en given materialbindning. Enda sättet att ändra
bindningens distansfaktorer är att ändra bindningsformens temperatur (E=hf).
Kovalenta bindningens allmänna
form
Växande kärnladdning reducerar atomära Coulombattraktionen
Med
en (till att börja med grovt) approximerad giltighet (med prövning från
Ämnestabell i Tabellflik 1 i Kalkylkortet, nedan) gäller sambandsformen för Vätebindningen [se
inledande härledning i Grundämnesmetallernas
brotthållfasthet]
F/A = (ke2/π√2)/d04 ................................. vätebindningens sammanhållande ytkraft, k = 1/4πε0
också
(i varje fall, men med vissa spridningar) för metallerna enligt
För etablerad definition av Kovalenta
bindningen, se Kovalent bindning.
F/A = (1/Z)(ke2/π√2)/d04 ......................... kovalenta bindningens sammanhållande ytkraft
generellt mellan två lika atomer
med d0
lika med grundämnesmaterialets atommedelavstånd. Tabellen nedan med Rm | beräknat MPa visar några
metalldata till jämförelse.
Jämförande tabell — Brotthållfastheten Rm som funktion av ämnets
reciproka atomnummer Z
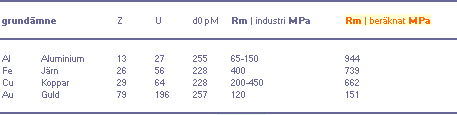
Data ovan samma som i ÄMNESTABELLENs data i Kalkylkortet, Tabellflik 1.
Värdena ovan ansluter till Diagram Rm1.
Frånsett
aluminiumfallet är det tydligt att överensstämmelsen är hyfsad [med viss
materialbearbetning ligger värdena inom materialgränserna].
En
mera omfattande jämförelse för samtliga grundämnesmetaller, sambandet ovan, ges
i Brotthållfastheten
för grundämnesmetallerna.
Motsvarande
mönsterform för den sammanhållande
kraften i materialets kubiska medelatom
— energibindningsinnehållet per M³ materialmedelatom — blir (Se utförligt från grundsambandet samt Kovalenta allmänna atombindningsformen)
Kovalenta bindningen, energiformen
F/A = K/d03 ............................................. Den sammanhållande ytkraftens kubiska
fördelning, se Grundform, Pa [=N/M²]
F/A = H(√8)/24πd03 ................................ via Hamakerkonstantens [delvis konventionellt
kaotiska] sambandsform, van der Waalskraften
........................................................... Se förklaring från Allmänna samband, enhet i N/M² =
Pa (Pascal)
Som vi redan uppmärksammat [se från Grundsambandet] används varken
sambandsformer eller termer i MAC i någon motsvarighet
till ovanstående: van der Waalskrafterna förekommer [tydligen]
inte som definitionsbas för KOHESIONSKRAFTER — ovan — utan används genomgående för
ADHESIONSMATEMATIK, se särskilt citat som belyser samband och
begrepp som används konventionellt.
Svaret på Frågan om vilken [enkel, begriplig] sambandsform i MAC som används för just
kohesionsmatematiken har eftersökts på webben, men ännu inte påträffats; Många
webbkällor använder termen KOHESION men utan att precisera någon sambandsform.
Se
även noteringen till Kohesionsmatematiken i Modern akademi.
PRECISIONEN
hos [den förenklat, approximativa] Kovalenta
bindningens allmänna form
F/A = (1/Z)(ke2/π√2)/d04 ......................... kovalenta bindningens sammanhållande ytkraft
generellt mellan två lika atomer
i
samklang med kovalenta bindningens
energiform [F/A=K/d03=H(√8)/24πd03]
som ovan kan testas i jämförelse med redan kända experimentellt genomförda
mätningar på — främst — de olika grundämnesmetallernas brotthållfasthet.
På Internet finns MatWeb, en omfattade databank på olika material och som kan
användas helt gratis för allmänna syften, bland annat data på
grundämnesmetallernas brotthållfasthet (Ultimate Strength). Sambandsformen
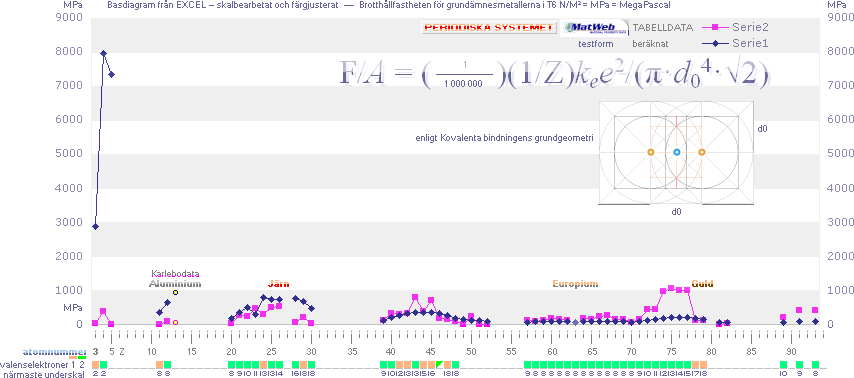
närmast ovan visas nedan i Diagram Rm1 — till jämförelse i diagrammet som Serie 1 [mörkblå],
MatWeb-data [med vissa komplement] som Serie 2 [ljusviolett].
Diagram Rm1 — Diagram
Rm2 · Diagram Rm3 — Grundämnesmetallerna
![]()
Brotthållfastheten för grundämnesmetallerna — lägsta värdena motsvarande glödgat tillstånd efter svalning [rumstempererat]

▬▬▬
Experimentellt
▬▬▬
Beräknat enligt Kovalenta bindningens grundgeometri, se även
ikonillustration i Grundformen Justerad.
PRIMÄRA GRUNDÄMNESDATA FRÅN sammanställda
källdata i Kalkylkortet i PERIODISKA SYSTEMET.
Brottgränsdata [Rm] i MPa [som ovan i
huvudsak] från Internetkällan MatWeb Nov2010 —
Kovalenta
bindningens grundgeometri, se från Vätebindningen H—H.
KÄLLDATA: Uppgifter på brottgränser [eng.
Ultimate Strength] från MatWeb;
Endast
lägsta brottgränsvärdet har medtagits — beroende på bearbetning [och
grundframställning] kan en viss mindre spridning uppåt förekomma, vilket
utjämnar skillnader i diagrammet.
Grunddata med atomvikter och medeltätheter
från sammanställningen av källverken i PERIODISKA
SYSTEMET.
Kort
beskrivning. Frånsett primärmetallerna i Period 1 [Litium, Beryllium,
atomnummer Z=3 och 4] och metallgruppen i Period 2 [Natrium, Magnesium,
Aluminium], samt intervallet Z=73-77 visar den relativt enkla sambandsformen [Kovalenta bindningens
allmänna form, F/A-sambandet infällt i figuren] en uppenbart grovt
approximativt orienterande samstämmighet med motsvarande tabelldata.
Jämförelsen ger tydligen vissa belägg för att KOVALENTA BINDNINGSGEOMETRINS GRUNDFORM kan förstås relevant som
grundpreferens — ehuru inte exakt beskrivande i den egna enkla formen.
Vi ser [genom separat analys, diagrammet längre upp] att differenserna
tecknar en ungefärlig exponentiell variation från lägre Z till högre Z; Med en
enklare funktionsjustering (med början från lägst Z=3, Litium)
Kovalenta
bindningsgeometrin som beskriver grundsambandet
F/A = (1/Z)(ke2/π√2)/d04 ......................... kovalenta bindningens sammanhållande ytkraft
generellt mellan två lika atomer
Se från Kovalenta bindningens allmänna form
y
= (F/A)·100[0,000008Z
+ 2([Z–1]/2)–2]
2010-11-07
Graf
y=100(0.000008x+2([x–1]/2)'–2) Unit5
Den justerande grafen som ger en betydligt
bättre överensstämmelse med experimentellt uppmätta brottgränser.
visar sig också en betydligt bättre
överensstämmelse, diagrammet nedan:
Funktionsjusterad Rm från Rm1 — Diagram Rm1 · Diagram Rm3
grundämnesmetallerna
![]()
Brotthållfastheten för grundämnesmetallerna
från Z=3 [Litium] — OBS lägsta värdena
motsvarande glödgat tillstånd efter svalning [rumstempererat]
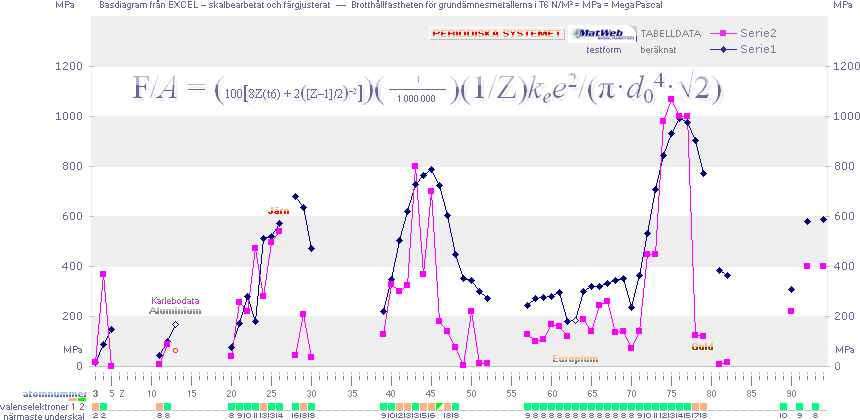

▬▬▬
Experimentellt
▬▬▬
Beräknat enligt Kovalenta bindningens grundgeometri, se även
ikonillustration i Grundformen Justerad.
F/A
= (100[8Z(t6) +
2([Z–1]/2)–2])(1/Z)kee2/(π·d04·√2) ...................... N/M² = Pa
PRIMÄRA GRUNDÄMNESDATA FRÅN sammanställda
källdata i Kalkylkortet i PERIODISKA SYSTEMET.
Brottgränsdata [Rm] i MPa [som ovan i
huvudsak] från Internetkällan MatWeb Nov2010 —
Som vi ser är följsamheten markant — men
ytterligare (mera komplicerad) analys för ännu bättre överensstämmelse kräver
tydligen speciella intervallfunktioner (resonansvillkor), vilket dock här
lämnas för vidare.
SAMMANFATTNING
KOVALENTA
BINDNINGSGEOMETRINS GRUNDMATEMATIK I HÅLLFASTHETSLÄRAN
Kovalenta
bindningens allmänna form
F/A = (1/Z)(ke2/π√2)/d04
............................................................. kovalenta bindningens sammanhållande ytkraft
generellt mellan två lika atomer
modifierad
nedan från Diagram Rm1 med något större samstämmighet mot mätdata i Grundämnesmetallernas brottgränser via justerade
sambandsformen
F/A = (100[8Z(t6) + 2([Z–1]/2)–2])(1/Z)kee2/(π·d04·√2) ............ N/M² = Pa
har i
samklang med kovalenta bindningens
energiform [F/A=K/d03=H(√8)/24πd03]
genom tabelljämförelser [Diagram Rm1 och Diagram Rm2] tydligen visat att det finns en ENKEL ELEMENTÄR
SAMBANDSMATEMATIK, den ovan nämnda, för allmän orientering och översikt i
materialens praktiska grundkemi, och analog med den gängse brukade termen [‡] van der
Waalskraft för sambandsformen K/d03:
här således materialatomernas
sammanhållande — kohesiva — kraft och energi. Med den samhörigheten understryks (här) endast att Hamakerkonstanten [H] för ett visst material [under bestämda betingelser]
tydligen kan beräknas direkt ur kännedom om materialets brottgräns enligt
= Rmd03[24π/(√8)]
............................................................... med d0 som kubiska atommedelavståndet
Rm anger brottgränsen i N/M²=Pa, d0 anger
materialets kubiska medelavstånd enligt Kovalenta bindningsgeometrins grundform, från Vätebindningen H—H.
Se
även separat beskrivning i Hamakerkonstanten
från Rm.
Ett omnämnande av den beskrivna ordningen,
eller en motsvarande omskrivning i MAC, har eftersökts på de tillgängliga materialdomäner som
finns på webben, men ännu (Nov2010) inte påträffats. Se även från INLEDNINGEN.
BILDKÄLLA:
Författarens arkiv · Bild219 R2010·13apr · Nikon D90 · Detalj
VdW — Materialens sammanhållande energi
Jämför
först »Kemistudentens inledande
Observation» om ej redan bekant
MATERIALENS
SAMMANHÅLLANDE ENERGI
VAN DER WAALS KRAFTER
I RELATERAD FYSIK framträder »van der Waals krafter» i ett
[betydligt] annorlunda ljus i samband med TNED-teorin generellt för
elektronmassan och elektronmassans
komponenter jämfört med den [delvis kaotiska, se Förklaringen]
beskrivningsbild som ges från den moderna akademins etablerade litteratur.
Beskrivningen nedan ger en översiktlig genomgång — enligt TNED.
”van der Waalskrafter är en
sammanfattande beteckning på svaga
bindningskrafter som verkar mellan atomer
och molekyler.”,
FOCUS
MATERIEN 1975 s150sp1mn
Relevansen
i TNED-resultaten
[Se TNED-Casimir]:
ADHESIONSKRAFTEN mellan två åtskilda plana plattor av ett visst
material som närmas till noll plattavstånd ska inte under några som helst
praktiska omständigheter för fasta ämnen nå upp till materialets naturliga
brottgränsvärde (Rm). För att komma dit nämligen, måste från max
adhesionskraft ytterligare en viss kraft (minst
5-10 ggr Re-värdet)
anställas för att få motsvarande kemisk fogning som kan uppvisa inslag av Rm.
— VID
nollavstånd mellan två idealt plana elektriskt oladdade materialytor —
motsvarande normalt närliggande atomplan — ligger mekaniska adhesionsspänningen
alltid under, lägre än, materialets brottgränsvärde (Rm).
Med exempel från Järn [SIS 17 07-02] vid rumstemperatur, brottgräns Rm = 400 MPa och
atommedelavstånd 0,228 nM [från medeltätheten 7870 KG/M³], visar TNED-formen adhesionstrycket 166 MPa; För att åstadkomma kemisk
förening måste ett ytterligare intryck påtvingas materialet (deformation med
minst 40%) med 5-10 ggr Re-värdet (enligt uppgift från industristandard, se Kallfogning); Re-värdet (elasticitetsgränsen) ligger generellt och här i
en grovt generaliserande mening för översiktens del på ca halva Rm-värdet
[Se Tabellexempel
i anslutning till Brottgränsgrafen]; Rpn-gränsen (som Re-värdets absolut sämsta fall) ligger alltid under/lägre än Re-området.
Kallfogning. Med CASIMIREFFEKTEN (atomattraktion mellan närliggande materialytor) uppstår
spontant tanken om en motsvarande kallfogningsteknik: Principen att via
en (extra) sammanpressningskraft kunna uppnå en motsvarande varmfogningsstyrka
(som vid konventionell svetsning, lödning) enbart via rå tryckkraft utan
värmetillförsel. Se Kallfogning.
—
Generellt sett med andra ord: Även VID exakt uppnådda atommedelavstånd via
separat skilda materialytor som närmas varandra till noll, krävs (för fasta
ämnen) ALLTID extra kraft för att åstadkomma naturlig förening.
— Den
naturliga adhesionen räcker inte som sådan för att åstadkomma kemisk
förening (utom för ämnen med flytande materiebas).
—
Eller sagt på annat sätt: Van der Waals kraft F/A=H/ad3 som tydligen enligt Kovalenta
allmänna atombindningsformen
med resultatredovisning i Diagram Rm2 definierar den kohesiva (inre sammanhållande) styrkan i ett material ligger
ALLTID över TNED-formens adhesiva (attraherande) mekaniska tryck mellan två skilda
planytor som sammanförts till exakt nollavstånd. Den återstående delen tillhör
uppenbarligen kraftområdet för Kallfogning (eng. Cold pressure welding). Därmed framträder
en enhetlig bild för materialets adhesiva fysik inkluderat
kallfogningsmekaniken (och som det inte finns någon erkänt etablerad teori för [‡]),
tillsammans med van der Waals krafter och den motsvarande Casimireffektens fysik.
—
Varje atom fungerar initiellt som en isolator (±). För att förenas med andra
atomer måste isolationsspänningen genombrytas. Isolationsspänningen definieras
på minsta komponentens bidrag, lika med den genombrytande kraftens element: elektronmassans komponenter. Det är — enligt TNED — tydligen dessa som bär ansvaret för hela
föreställningen.
Forts.,
Grundsamband, inledning till
van der Waals krafter.

BILDKÄLLA:
Författarens arkiv · Bild11 Isglas · 2feb2010 · Nikon D90 · Detalj
Grundsamband, inledning VdW
GRUNDBEGREPP
I RELATERAD FYSIK
VAN DER WAALS KRAFTER
DEFINIERAR
MATERIALENS HÅLLFASTHET
Se
även van der Waals krafter inom
kemin
”van der
Waalskrafter är en sammanfattande beteckning på svaga bindningskrafter som verkar mellan atomer och molekyler.”,
FOCUS
MATERIEN 1975 s150sp1mn
Det finns MÅNGA webbkällor (Okt2010) som
uttrycker samma typmening som ovanstående citatform — och som likt denna också
saknar konkreta sifferdata för exakt jämförelse.
Se även från GRUNDSAMBANDET [där är utgångspunkten energin över hela
atomära medelkuben]:
ENERGIN [E=Fd] genom flödestvärsnittet (A)
mellan två närliggande atomer i kemisk förening i ett material har en idealt
kvadratisk ytfördelning via kraftflödestvärsnittet d² mellan atomkärnorna med d
motsvarande atommedelavståndet: E/A=K/d²; MEKANISKA YTSPÄNNINGEN mellan två
närliggande atomer eller atomplan får då formen av ett grundsamband
F/A = K/d³
................................ grundsamband
Den sammanhållande kraften fördelas tydligen
EKVIVALENT jämnt, homogent och idealt inom medelatomens kubiska volym d³.
Därmed är materialets hållfasthet (Rm) definierad: materialets
absolut starkast sammanbindande ytkraft. Det finns ingen starkare.
Betrakta
från grundsambandet ovan F/A=K/d3 ett (med alternativa
termer) motsvarande grundsamband
F/A = Hk/D03:
Grundsambandets
härledning
Ett
materials allra största sammanhållande kraft (F) definieras under alla
praktiska omständigheter av mekaniska spänningen (F/A=Rm)
som råder vid brott eller BROTTGRÄNSEN (kraften över brottytan, eng. ultimate
strength) då materialet sträcks ut tills det brister (se Brottgränsexempel, ett av flera olika sätt att testa materialets
hållfasthet),
Rm = MAX(F/A) ...................... N/M2
Variationen
i olika materials maximalt sammanhållande kraft kan då skrivas generellt
F/A = Rm
= K/d03 ................................. N/M2
med d0
som materialets medelatomavstånd.
Materialets
karaktäristiskt sammanhållande energikonstant [Se även GRUNDSAMBANDET från början i Grundläggande
Hållfasthetsbegrepp om ej
redan bekant] får alltså formen
K = Rmd03 ................................. (N/M2)M3 = NM = J
Genomgår
materialet bearbetning som resulterar i en höjning av K-värdet,
atommedelavståndet förutsatt oförändrat [ingen volymändring, konstant
medeltäthet], höjs också materialstyrkan analogt med ett högre Rm-värde.
Dvs, K-värdet och Rm-värdet är [eller bör vara] direkt proportionella.
Med
tillägg av vissa konstanter (bl.a. π som kan återföras på det cirkulära
kraftflödestvärsnittet [π(d0/a)2] i
flödesvägen mellan atomplanen i ett material) får materialenergikonstanten K i det gängse betecknade van der Waals kraftsamband sin motsvarande form enligt den konventionella
benämningen Hamakers konstant
H = Kk
= Rm(24πD03) .................................. J ;
D0
~ 0,16 nM = 1,6 t10 M
= Rmd03(24π/√8)
Notering 1: Olika författare i MAC använder delvis olika pi-koefficient,
se citatreferenser i Allmänna samband.
Notering 2: I MAC används (genomgående) ett
och samma (odefinierade) värde för D0. Den konventionellt
exakta innebörden av termen och dess antagna-påstådda värde har eftersökts i
webbens tillgängliga källor men ännu (Okt2010) inte påträffats.
med
här använda beteckningar. Se mera utförligt i Beräkning av Hamakers materialkonstant från Rm.
Sambandsformen — grundsambandet — för
ytkraften F/A kan då skrivas via H ovan
F/A = Rm ..................................... N/M2
Se även utvecklingarna från Allmänna samband. d0 anger materialets
atommedelavstånd.
Eftersom
brottgränsvärdet (Rm) definierar den maximala materialstyrkan, återstår ingen
övrig koefficientform att bestämma i samband med beräkningar som berör
materialets (för Rm specifikt längdrelaterade, tvärsnittsberoende)
sammanhållande fysik.
Med andra ord:
Hamakerkonstanten (H) kan beräknas direkt och exakt med
kännedom om materialets brottgränshållfasthet (Rm) enligt
(H) =
Rmd03
d0 anger materialets atommedelavstånd
Webbkällor
som omnämner, antyder, relaterar eller använder denna koppling har eftersökts
men ännu (Okt2010) inte påträffats.
För
att återförena det fasta ämnets brottytor till kemisk förening [Se KALLFOGNING]
med Rm-hållfasthet räcker det INTE med att enbart (vi frånser här
oxidationsfenomen och andra föroreningar) föra ihop de skilda delarna så
att de uppvisar noll separation — alltså rent tekniskt lika med att återställa
atommedelavståndet i brottytan. Därifrån krävs nämligen ytterligare (minst) 5-10 ggr materialets elasticitetsgränsspänningstryck, Re-trycket för att åstadkomma Rm-hållfasthet
— vilket innebär att brottytornas återförening till noll tvunget och i
vilket fall måste uppvisa en lägre attraktionskraft än materialets brottgräns
Rm. Men den adhesionsgränsmatematiken saknas
uppenbarligen i MAC:
I MAC
används formen F/A=Hk/d3
generellt för att beskriva en ADHESIONSFYSIK (attraktion mellan olika material): en
påstådd (svag) attraktion mellan av d åtskilda olika ämnens materialytor
via variabla distansvärden för d-faktorn inom en och samma
laboratorielokals fasta temperatur. Koefficienten k
används f.ö. olika av olika källverk, se citatutdrag i Allmänna samband.
Men
som redan härletts ovan i grundformen via energitvärsnittet (Rm=Fd0/A=K/d02)
gäller sambandsformen F/A=Hk/d3
med variabel distans endast med ett visst bestämt energiinnehåll för ett visst
bestämt material och därmed endast med ett bestämt d-värde — motsvarande
materialets atommedelavstånd — vid en viss bestämd temperatur:
Sambandet F/A=Hk/d3 beskriver tydligen en KOHESIONSFYSIK (sammanhållande
kraftfysik) — med fasta d-värden;
d-värdet, analogt materialets masstäthet, kan bara ändras
med ändrad temperatur; Man kan, då tydligen, inte använda sambandsformen F/A=Hk/d3
för att beskriva attraktionen mellan åtskilda materialytor; Sambandet
F/A=Hk/d3
är tydligen och uppenbarligen enligt Grundsambandets härledning en kohesionsekvation — reserverad
för ett materials egen inre brotthållfasthet (Rm).
Inget annat; d=d0=MATERIALENS FASTA ATOMMEDELAVSTÅND:
Kan bara ändras med ändrad temperatur.
Man har i MAC ingen adhesionsgränskurva — utan
kompenserar denna med VdW-formen 1/ad^3 inom en främsta avgränsad
intervalldel 0-[10-20]nM, och som sedan sägs övergå i Casimirformen 1/d^4 även benämnd ”the retarded van der
Waals”. Men den experimentella redovisningen i området
0-10-20nM är i princip orepresenterad samt generellt för större distanser även
ytterst svårtillgänglig, främst beroende på svårigheterna att utföra mätningar
mellan parallella planytor [Se citat i CasimirRef]: Experimentatorerna
söker istället kompensera med en anordning Platta-Sfär — och som därmed lämnar
grundformen Platta-Platta resultatlös och obemött. Dvs., det finns (ännu
Okt2010) inga direkt tillgängliga grunddata att jämföra med.
Med
hjälp av TNED-teorin för elektronmassans
komponenter kan man emellertid [relativt] jämföra PRINCIPKURVORNA i de
olika funktionerna och se att differenser och marginaler gränsar intill
varandra inom funktionsområdet 1/ad^2—4. För mera exakt verifikation i någon
definitiv favör för TNED krävs dock mera utförligt redovisade experimentella
resultat på just området Platta-Platta.
Tabellen
nedan visar — till jämförelse — Hamakers (material)konstant (H).
Hamakerkonstanten (H) visas DELS via
beräkning från brottgränsen (Rm, eng ultimate strength) och DELS i jämförelse med
tillgängliga webbkällor (markerade s1-s5 i tabellen och som garanterat INTE har
fått sina värden från Rm-beräkningar — begreppet ultimate strength omnämns inte ens i de
upptagna källverken, genomförd särskild sökning 2010-10-28).
FATTIGDOMEN ”—” I JÄMFÖRANDE DATA — trots
en stor mängd tillgängliga dokument — talar för sig själv: Ämnet är så
grundligt dåligt representerat i kunskaper och kännedom att man undrar HUR i
all sin dar … .
—
KOPPAR — men vilken sort? Webbkällorna [s1, s2, s4, s5] ger inga besked.
[Alla
som känner materialläran något i grunden vet att ett ämnes
hållfasthetsegenskaper ändras med bearbetning — för just Kopparens del högst
väsentligt].
Jämförande
Tabell, Hamakerkonstanten
Jämförande
Tabell — H — Hamakers konstant [20°C] i
t20 J
|
ämne |
Rm|MPa |
typ |
ref |
SIS |
s1 |
s2 |
s3 |
s4 |
s5 |
|
|
|
Brottgräns |
|
|
|
t20J |
t20J |
t20J |
t20J |
t20J |
t20J |
|
Vatten |
28 |
vatten|13°C |
3 |
— |
2,23 |
— |
— |
3,7 |
— |
3,66 |
|
Aluminium |
65-150 |
renAluminium |
KMs285 |
40 07-02|18 |
2,88-6,64 |
6,3 |
— |
— |
— |
— |
|
Krom |
413 |
As-Swaged |
2 |
— |
13,22 |
— |
— |
— |
— |
— |
|
Järn |
400 |
Segjärn |
KMs205 |
07 17-02 |
12,60 |
— |
— |
— |
— |
— |
|
Kobolt |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
Nickel |
45-317 |
Nickel |
2 |
— |
1,32-9,29 |
— |
— |
— |
— |
— |
|
Koppar |
200-450 |
Kallvals.band |
KMs216 |
50 10 |
6,34-14,27 |
11 |
40 |
— |
27,3 |
12,2-27,5 |
|
Guld |
120 |
— |
2 |
— |
5,40 |
— |
40 |
— |
— |
— |
|
|
|
|
|
|
|
|
|
|
|
|
...... utan relativa dielektricitetstalet
ref 1 Brottgränstabell i Wikipedia
ref 2 MatWeb
ref 3 GOOGLEBÖCKER
s14 Figure 1.3, Sonochemistry and cavitation — M. A. Margulis 1995
KM MATERIALLÄRA
Karleboserien 5 1980
SIS materialdata
enligt Sveriges Standardiseringskommission
s1 http://heatexchanger-fouling.com/papers/papers2009/16_Lefevre_Hamaker_F.pdf
s2 http://hal.inria.fr/docs/00/26/44/38/PDF/JMM06_LAB_LRP.pdf
s3 http://courses.washington.edu/overney/Material/HandoutsChemE498/Hamaker_Constant.pdf
s4 http://pharmahub.org/resources/250/download/hamakerconstant_data.pdf
Länken
närmast ovan fungerar inte i Internet Explorer och Arora. [2010-10-28]
s5 GOOGLEBÖCKER
s28 Table 2.3, Surface and Interfacial Forces, Jürgen Butt, Michael Kappl 2010,
[AH exp.];
Jämför också källan närmast ovan
med Beräknat-Uppmätt: relativt stora skillnader visas till jämförelse.
ALLA TABELLENS WEBBKÄLLOR s1-5 saknar mer eller mindre
SPECIFIKA MATERIALPARAMETRAR för det angivna materialet.
Jämför till
exempel KOPPAR — som kan ha en stor mängd olika Rm-värden beroende på bearbetning —
H-värdet ökar med ökad mängd inlagrad bearbetningsenergi (Jämför t.ex. s2 med
uppgiften 40 t20J: vi vet inte under vilka betingelser som Det angivna
materialet BLEV sitt eget material vid tillverkningen, eller OM man påverkat
materialet något EFTER tillverkningen — vilket gör jämförelsen i princip
värdelös).
NOTERA OCKSÅ DIVERSITETEN KOEFFICIENTER i det etablerade
användandet av van der Waals kraftsamband, se Allmänna
samband:
F/A = H/6πd3, ELLER H/12πd3,
ELLER H/24πd3 … . Olika källor använder olika
sambandsformer — ÄVEN med referens till SAMMA urkund, se jämförande citat i Allmänna samband. ENBART på den delen
finns i princip en fyrfaldig differensfaktor.
NOTERA ÄVEN ATT TEORETISKA HAMAKERKONSTANTBERÄKNINGAR
[från Lifshitz teorier] använder (det förenklade) sambandet mellan
brytningsindex och dielektricitetstal — tydligen utan andra inslag. Materialets
BEARBETNING måste tas med i beräkningen.
Van der Waals
krafter — Van der Waals, efter (1873) holländaren Johannes Diderik van der
Waals (1837-1923)

BILDKÄLLA:
Författarens arkiv · Bild3 U2009/2 · 4MAJ · Nikon D90 · Detalj
Van der Waals krafter
VAN DER WAALS KRAFTER
Efter
(1873) holländaren Johannes Diderik van der Waals (1837-1923)
Relaterad
fysik: VAN DER WAALSKRAFTERNA
(ofta förk. VdW) — intermolekylärt sammanhållande krafter i området 0,1-10nM;
Modern akademi: För citatexempel som visar hur van der Waals
kraftsamband beskrivs konventionellt, se Övergången
VdW-Casimir.
I varje fall med den diversitet av H-värden [Hamakers konstant] som finns i webbutbudet
(Okt2010), se HamakerExempel, finns det ingenting som hindrar att
sambandet F/A=H(24pi)/d³ kan förstås beskriva de fasta
materialens brottgräns (Rm).
Van der Waals krafter i materialsammanhang
intar en synnerligen mysko ställning i den etablerade litteraturen. Se van der Waals krafter inom
kemin för en inledande orientering. Man tycks nämligen generellt vara
av den uppfattningen att TROTS att van der Waals samband F/A=K/d³ beskriver ett
materials brottgräns (Rm)
Se även från Grundsambandet:
ENERGIN [E=Fd] mellan två närliggande atomer i
kemisk förening i ett material har en ytfördelning via kraftflödestvärsnittet
d² mellan atomkärnorna med d motsvarande atommedelavståndet [E/A=K/d²];
MEKANISKA SPÄNNINGEN mellan två närliggande atomer eller atomplan får då formen
F/A=K/d³: Den sammanhållande kraften fördelas jämnt och homogent inom
medelatomens kubiska volym d³. Därmed är materialets hållfasthet (Rm) definierad: materialets
absolut starkast sammanbindande ytkraft. Det finns ingen starkare.
framhålls van der Waals krafter som SVAGA
KRAFTER [‡] framför typen JONBINDNINGSKRAFTER och KOVALENT BINDNING [‡]. Men ett materials mest
sammanhållande kraft kan inte vara större än den som definierar materialbrott.
Här är det med andra ord verkligen något som inte stämmer i den moderna
akademins lärosystem.
Kovalenta allmänna atombindningsformen
Grundämnesmetallernas
brottgräns, F/A=Rm:
Kovalenta allmänna atombindningsformen
F/A = (100[8Z(t6) + 2([Z–1]/2)–2])(1/Z)kee2/(π·d04·√2) ............ N/M² = Pa
visar samma resultat [Se Diagram Rm2] som sambandsformen [se Brottgränsen]
F/A =
H(√8)/(24π)/d03
.................................................................
Det första sambandet [elementet] ger EXPLICIT ytkraften via den kovalenta bindningsformens
cirkulära flödesskiva (radien=d0),
A = [A=π[d0/2]2]/√2
= πd02/√2
Det andra sambandet [materialet] — van der Waals kraftsamband — ger fördelningen
explicit över materialets medelatomkub — kvadraten ovan i centrum, kubsidan d0
— direkt.
Bägge sambanden uttrycker samma fysik med
samma värden men genom olika flödesprefix. Se även från Grundsambandet.
—
Eftersom sambandsformen i det andra fallet tydligen är van der
Waalskraftsambandets form — se t.ex. hur den formen också beskrivs
konventionellt i Övergången Casimir-VdW — finns uppenbarligen INTE saklig grund för att påstå
någon distinktion
mellan »de allra starkaste av de kovalenta
bindningskrafterna» — Vätebindningen H—H ovan i figurlogon och som ger kvantitetsintervallet
0-1000 MPa för samtliga Grundämnesmetaller — och just van der Waalskrafterna: de senare definierar tydligen per exempel materialhållfastheten
VIA den allra starkaste kovalensbindningen av alla: vätebindningen. Se resultatredovisningen explicit i Diagram Rm2.
Samhörigheten är beviset.
— Om allt är korrekt
uppfattat är förklaringen till »den etablerade språkförbistringen» alldeles
tydligt den här [klicka på bilderna för
originalet]:
Van
der Waals-sambandets kurvskara [1/ax^3, ljusvioletta ovan, a-koefficienterna
markerade underst, klicka på bilderna för
originalet] TROS i MAC vara en adhesionsbeskrivande fysikalisk matematik som tar vid mot noll där »Casimirgränsen slutar», vid grovt 10-20 nM.
Men — som visas i den här framställningen per jämförande exempel med grundämnesmetallerna i PERIODISKA SYSTEMET, se Diagram Rm2 — van der Waalssambandet beskriver INTE adhesionsfysiken
utan kohesionsfysiken: materialens fasta, sammanhängande
bindningskrafter och energier. I TNED harmonierar den beskrivningen också via den gröna kurvan i figuren ovan som, verkligen,
gör anspråk på att beskriva adhesionsfysiken — hela vägen, från atommedelavstånden och utåt, eftersom Casimireffekten i TNED inte har »vakuumets
nollenergi» som orsak utan elektronmassans
komponenter [funktionsformen
1/ax^2TILL4, gröna-ljusblå kurvorna ovan; Notera att tilläggskoefficienter
finns här också (för dielektrikum, här utelämnade) och som i det praktiska
fallet innefattar också nivåalternativ
för denna kurvtyp]. Men som också
understryks i Teknisk Verifikation — området är synnerligen svårmanövrerat
för direkt teknisk bevisning: inga definitiva besked finns ännu — även om
teorin förefaller uppenbar.
— MAC saknar en reguljär —
sammanhängande — ADHESIONSKRAFTSTEORI. Vi finner den beskriven i MAC genom en (inte sällan
kaotisk) uppdelning i å ena sidan van der Waals kraftsamband med början från
kortaste avstånden till (en s.k. retarderad version av denna som)
Casimirkraften [Se VdWCasimir och Övergången Casimir-VdW] som associeras med
större avstånd. ORDNINGEN mellan dessa är (ännu Okt2010) synnerligen oklar [Se CasimirRef] — inte minst på grund
av att man rent experimentellt inte kan lösa svårigheterna med användning av
två parallella planplattor [Platta-Platta-experiment] utan söker förenkla
avhandlingen med Platta-Sfär-experiment, och bara med nettoeffekten att
GRUNDTEORIN med Platta-Platta-verifikationerna står obemötta [och skjuts på
framtiden]. Se även citaten i Hamakerkonstanten.
— Men från materialläran
(främst metallerna) VET vi redan att maximal adhesion mellan två planytor av
ett givet material (oxidationsskikt och föroreningar frånsett) INTE föranleder
kemisk förening med nollavstånd mellan planytorna: det behövs ytterligare en
sammanpressande kraft [på minst 5-10 ggr Re] för att en sådan kallpressfogning ska realiseras — teori saknas i MAC.
— Och alltså kan inte
adhesionsfysiken tillämpas i någon praktiskt teori på van der Waals
materialbrottsdefinierande sambandsform.
— Uppenbarligen är det
(alltså) så: van der Waals kraft beskriver materialets hållfasthet, medan
adhesionskraften utnyttjar en annan funktion
och som tydligen saknas i MAC — och som (därför,
vilket uppenbarligen är det kaotiska) substitueras
med van der Waals kraftsamband. Se exv. eng. Wikipedia Adhesion.
— Allt och tydligen på grund av att man
bannlyste elektronmassans
komponenter från 1927, uppenbarligen de enda som kan förklara
sammanhanget och reda ut oklarheterna. Se även sammanställningen i LEC [Lambväxlingen, Elektronens g-faktor,
Casimireffekten].
Allmänna samband
Vid
genomsökning på webben (Okt2010) på samband som beskriver van der Waals
krafter uppdagas samtidigt en del oklarheter. Ytkraften (F/A=K/d3)
framställs olika i olika källverk — även med inbördes referens till
SAMMA källa:
F/A = H/6πd3
................................ WU1.s11ö.Table 2, enhet
i N/M² = Pa (Pascal)
Källan refererar till ................................... [Intermolecular and Surface Forces,
Academic press, J. Israelachvili 1985]
;
F/A = H/24πd3
.............................. Wikipedia Adhesion, enhet i N/M² =
Pa (Pascal)
Källan refererar till ................................... samma som ovan
;
F/A = H/24πd3
.............................. Nanomedicine, Freitas 1999, enhet i N/M² =
Pa (Pascal)
Källan refererar till ................................... Kevin Kendall, "Adhesion: Molecules
and Mechanics," Science 263(25 March 1994)
Den
första källan ovan genomgår något som liknar en härledning (men med mager [i princip obefintlig] relaterbarhet):
Utgångspunkten [WU1s15n][källförfattaren
använder A för Hamakers konstant, här H] är en ENERGIYTA (eg, energiyttäthet
eller energitryck) E/A=(H/12πD02)
med innebörden ”total
energy of two planar surfaces att distance D>D0 apart” — men som sedan summeras på endast halva beloppet
enligt ”Thus, in order to
separate the two surfaces one has to overcome the energy difference [som ovan], which corresponds to the adhesive energy per unit area” via 2(E/A) så att E/A=(H/24πD02),
”Hence, the interfacial
energy can be expressed as a function of the Hamaker constant and the cutoff
distance”, som ovan.
— Det
är tydligt att den beskrivningen inte går ihop med ytkraften och dess variation
från noll mot oändligt: Maxvärdet måste under alla förhållanden avspegla
energiytans toppvärde per minsta distans: E/A=FD0/A.
— Är
maxvärdet för energiytan av formen E/A=(H/24πD02),
måste veterligt också maxvärdet för kraftytan gå via E/A=(H/24πD02)=Fd/A
som via d=D0 ger maxvärdet F/A=(H/24πD03).
Det finns, här veterligt, ingenting annat att välja på.
—
F/A-maxvärdet är under alla förhållanden den kraft som sammanhåller materialet,
också samma som materialets brottgräns (sv. Rm)
(eng. ultimate [tensile] strength).
Utan
någon annan referens än ovanstående används i det följande grundsambandet
F/A = H/24πd3
.............................. Se förklaringen ovan i Allmänna samband, enhet i N/M² =
Pa (Pascal)
som
allmän (generaliserad) beskrivning för den sammanhållande kraftverkan (KOHESIONEN) mellan två idealt närliggande atomkuber via deras angränsande
ytkvadrat eller motsvarande angränsande atomplan, eftersom någon annan tolkning
av sambandsformen inte kan utläsas i relaterad mening, se från Grundsamband. Distansen d med minsta värdet D0 — (i den konventionella beskrivningen
angiven som eng. cutoff [eller cut-off] distance), se Cutoff Distansen — kommer då att motsvara eller avspegla materialets
fasta atommedelavstånd och som bara kan ändras med ändrad temperatur, analogt
energiinnehåll.
Exakt vad det konventionellt brukade
uttrycket ”cut-off distance” står för i MAC verkar ytterst svårt att reda ut. Det anges [Washingtonkällan, s16m] som
typiskt med värdet ca 0,16 nM = 1,6 Å (som en generell konstant),
men det verkar inte finnas någon källa som kan klargöra varifrån termen kommer,
vilken dess innebörd är, eller om den ska tolkas som en konstant eller variabel
(olika källverk verkar använda olika sätt, utan närmare förklaring).
Värdeintervallet 0,165-0,185 nM som anges
av Bhattacharya et al., 2008 är i vilket fall runt 1/√2 kortare än de fasta
ämnenas atommedelavstånd (vid
rumstemperatur; grovt runt 2,5 Å med relativt små variationer).
Den konventionellt framhållna förtegenheten
(godtycket och avsaknaden av förklaringar) ikring begreppen vittnar om att
grundteorin lämnar en del övrigt att önska. [Grundteorin är uppenbarligen
inte välformulerad].
Elastiska separationstrycket — kraftvägens distans över
separationen
HÅLLFASTHETSBEGREPPET
kräver en minsta distans mellan ett (grund)ämnes atomer, och den distansen kan
ingen annan vara än ämnets (idealt kubiska) medelatomavstånd dATOM=[Uu/(ρV=m)]1/3.
Genom att D0-parametern (i etablerad användning) tydligen är kortare
med en faktor a kan vi förtydliga F/A-formen ovan via
D0 = dATOM/a
enligt
maxkraftgränsen
F/A = Ha3/24π(dATOM)3
och därmed den allmänna distansformen för van der
Waalskraften
F/A = Ha3/24πd3
........................... Se förklaring i Allmänna samband, enhet i N/M² =
Pa (Pascal)
med lägsta värdet d=dATOM.
Eftersom
(tydligen) flera etablerade verk ansluter till användningen av ’cutoff distance’
D0~1,6 nM kan vi tydligen approximera a för dessa fall genom
rotkoefficienten i Kovalenta bindningens
grundform [A=[A=π[d0/2]2]/√2=πd02/√2 — se inledande sammanfattande beskrivning i Grundämnesmetallernas brottgränser] som
a =
√2
med
typexemplet JÄRN (26Fe56) som vid rumstemperatur uppvisar atommedelavståndet
2,28 Å [0,228 nM eller 228 pM]:
2,28/√2 = 1,6155034
~ 1,6 = D0
Och
som vi ser, är approximationen (i varje fall för detta fall) god.
Gränsen för materialbrott — mekanisk separation (ångbildning för
vätskor)
Med (a=√2)3=√8=2√2
därmed
F/A = H(√8)/24πd3
....................... Se
förklaring från Allmänna samband, enhet i N/M² =
Pa (Pascal)
=
H(√2)/12πd3
= H(0,0375131)/d3
med lägsta värdet d=dATOM=[Uu/(ρV=m)]1/3.
Observera att H-värdet [Se Tabell]
1. varierar betydligt som sådan [med
tabellexemplet] 0,057 [Flytande Helium] till 40 [ädelmetallerna],
2. saknar [enkel, allmän] konventionell
beskrivningsform: olika uppgifter ges för samma ämnen från olika källor, se Hamakerkonstantens
innebörd och HamakerExempel;
Rm = (F/A)max ;
H = Rm(24πd3)/√8
; d
= dATOM
= Rm(dATOM)3(26,657297)
Se även Hamakerkonstanten från Rm.
För att få fram motsvarande a-koefficient i funktionen p/(pUNIT)=1/ad3 via dUNIT utförs
beräkningen
p = H(0,0375131)/(dUNIT)3 .... Pa ;
a = (pUNIT)/p
;
= (dUNIT)3(pUNIT)/[H(0,0375131)]
Funktionsformen
motsvarar en idealt sfärisk tryckdisposition av typen kubisk, figuren nedan.


Kraftytans funktion får tydligen innebörden av
en kubiskt homogen fördelning via d^3.
Värdeformen
F/A ovan motsvarar attraktionen mellan molekyler eller motsvarande
planmolekylytor då de separeras av d — men utan att separationen
åstadkommer materiellt- eller substantiellt brott. Dvs., idealt utan materialbrott
— och därmed en ideal »elasticitetsattraktion», den avtar med växande
separation.
Observera dock att maxvärdet ovan [via »ett
bestämt H-värde» som i praktiken varierar med ett givet materials tillstånd]
inte ger något exakt facit till praktiska brottgränsvärden för olika
material — i praktiken kan tiofaldiga värden förekomma. Se exempel nedan.
Exempel:
Brottgränsen
praktiskt för Kisel [ett kristallint mycket hårt sprödmaterial med ringa
elasticitet] anges vid Proportionalitetsgränsen i Wikipediatabellen till 5-9 GPa.
I webbkällan
s233sp1.ekv.13
MESA
Research Institite, University of Twente —
STICTION
OF SURFACE MICROMACHINED STRUCTURES AFTER RINSING AND DRYING: MODEL AND
INVESTIGATION OF ADHESION MECHANISMS — Legtenberg, et al., 1994
http://eprints.eemcs.utwente.nl/14053/01/JSAA_43_230.pdf
ges
ett exempel via sambandet E/A = H/24πD02 med
uppgiften 90 mJ/M² för Kisel och H
= 27 t20 J. Utför vi en division med d=0,2 nM (källans
uppgift) ges max
F/A = (0,09)/(0,2 t9 M)
= 4,5 T8 N/M²
= 450 MPa
För
att matcha Wikipediatabellens uppgift på 5-9 GPa krävs alltså minst en
tiodubbling.
Exemplet visar att man visst, inom vissa
rimliga gränser [med referens till »allmänna uppgifter på webben»], kan
bilda sig en viss uppfattning om ett visst materials hållfasthetsparametrar i
en grov översiktlig mening — men då förutsatt tillbörlig hänsyn tagen till
parameterkomplex som också kan driva värdena (typiskt) tiofalt (åt bägge
hållen).
Beräkning av Hamakers materialkonstant från Rm
H = π2C ·ρ1·ρ2
.......................... J
ρ
antalet
atomer per volymenhet i resp. materialdel [ref. @INTERNET Wikipedia
Hamaker constant 2010-10-19]
C specificeras inte i wikipediaartikeln utom
”the coefficient in the particle-particle pair interaction [1]”; referensen
leder till en artikel man måste betala för att få läsa.
Om D0-konstanten
(~0,16 t9 M)
tas för given för samtliga fall, kan — med ledning av en tabell över olika
materials (sv. bet. Rm) brotthållfasthetsgränser (eng. Ultimate strength)
en ekvivalent till Hamakers konstant (normalt komplicerad interatomär materialparameter)
framräknas från föregående Hamakerbrottgränsen Rm=F/A= H/24πD03
enligt
H = Rm(24πD03) .................................. J ;
D0
~ 0,16 nM = 1,6 t10 M
= Rm(3,08831 t28 M3) .................... J
~ Rm(3,1 t28)
................................... J
C-faktorn i Hamakerkonstanten kan
då också förtydligas enligt
H = π2C
·ρ1·ρ2 = Rm(24πD03) ; [ref.
@INTERNET Wikipedia Hamaker constant 2010-10-19]
C = Rm(24D03)(πρ1ρ2)–1
........................ J, förenkl., samlade
energiinnehållet per materialatom [Kohesiva (sammanhållande) materialenergin]
= Rm(24D05)(πD02ρ1ρ2)–1
; ρ[perM3] = (ämnestätheten i KG/M³)/Uu
Rm — för
ETT givet ämne [som betyder att ρ1=ρ2] — beror på struktur,
orientering, [elektronresonanser] — bearbetning, tryck, temperatur
(bestrålning, elektriska/magnetiska fält)
HamakerExempel,
olika konstanter
EXEMPEL:
Koppar
(glödgad eng. annealed = maximalt elastisk) anges i Wikipediatabellen med motsvarande
Rm = 210 MPa =
210 T6 Pa = 2,1 T8 Pa ;
Insättning
i sambandet ovan ger
H = 6,51 t20
J ;
Ser vi
efter i olika mätrapporter kommer vi att finna andra, olika värden — beroende
på i vilka materiella sammanhang värdeformerna figurerar — för att exemplifiera
»ämnets vassa natur»;
Jämför exv. webbkällan
s123Table2
(källan kan markeras men inte kopieras), ”Result of calculations for
copper/water interfaces using summation (2).”,
http://heatexchanger-fouling.com/papers/papers2009/16_Lefevre_Hamaker_F.pdf
:
Kisel 1,7
t20 J
Aluminium 6,3
BeO 6,0
CaCO3 3,6
MgO 4,9
Quartz 3,1
TiO2 6,5
ZnO 3,3
Fe2O3 6,7
Cu 11
med
s4Table1,
”Values of Hamaker constant for some materials A × 10−20J
[22]”
— Koppar: i vakuum
40 t20 J; i vatten 30 t20 J,
FORCES
ANALYSIS FOR MICROMANIPULATIONS IN DRY AND LIQUID MEDIA — Gauthier et al.,
2008
http://hal.inria.fr/docs/00/26/44/38/PDF/JMM06_LAB_LRP.pdf
:
i
Vakuum i Vatten
Guld 40 30 t20 J
Silver 50 40
Al2O3 16,8 4,4
Koppar 40 30
Skillnaden
mellan ’11’ och ’40’ är inte obetydlig [källan anger heller inte typen av
koppar — skillnaden med mjuk-hård koppar kan avgöra med en faktor 2 (ref. Rm
ca 200-450 MPa, MATERIALLÄRA Karleboserien 5 1980 s216 Fig 10.3 SIS
Koppar 50 10)] — och vi inser att någon direkt enkel metod för teoretiska
interatomära materialparametrar INTE existerar (ännu, är det bäst att
tillägga).
Skillnaden i brotthållfasthet (F/A=Rm-sambandet
ovan enligt Hamakerbrottgränsen) skulle här ge en faktor 40/11~3,64; resultatet utesluter varje precisionsrelaterad beskrivning. [Man får tydligen acceptera teoretiska osäkerheter
inom en faktor 10 via enklare beräkningar som använder webbdata generellt].
Materialbrott efter dragning — 0mM5 Koppartråd · Författarens
arkiv · Bild4 · Materialbrott · 11Nov2010 · NikonD90
Det finns ingen »elastisk metallisk töjning» före brottgränsen
Frånsett ytterst marginella ändringar (här
uppskattningsvis från 100-delar och mindre av materialets medelatomavstånd —
här helt baserat på Hamarkonstantens ekvivalent, se Hamakerkonstanten från Rm) — bara faktorerna D0|Rm
kan påverka:
Frånsett
(möjligen) elastiska material som typ gummi (och olika plaster, organiska
material): Atommedelavstånden i säg ett stycke koppar som sätts in i en
dragprovmaskin och dras till brott, uppvisar ingen täthetsändring;
Kopparatomerna anpassar sig (»kryper» efter atomplanen) genom att — tydligen —
glida längs kraftvektorn och därmed göra staven smalare motsvarande
utdragningen; materialet »söker» ett avlastningstvärsnitt dit dragkraften drivs
av krypningen i formen av en maximalt försmalad »midja» [med inre tvärställda
atomplan i brottytan]. Där uppstår brottet. Omedelbart efter brottet
återgår (snabbt) den utdragna, brutna midjedelen till ett normaltillstånd (som
innebär att en del av midjan sjunker tillbaka och lämnar brottgränsens
mellanliggande intervall öppet). Vad vi vet, ändras inte materialets täthet det
allra minsta under processen.
Det
finns uppenbarligen ingen intermolekylär separation i en metalls dragning till
brott, endast en kristallin omfördelning (smidning, glidning, formändring utan
volymändring).
Sambandsformen
F/A = H(24pD03)–1
.......... N/M2
= Rm
som
beskriver materialets inre sammanhållning utan volymändring — med direkt
analogi till Grundämnesmetallernas
brotthållfasthet — beskriver
följaktligen en kohesionskraft, inte en adhesionskraft.
Men i
etablerad litteratur [‡] beskrivs Van der Waals intermolekylära kraft ofta som en ADHESIV (mellan olika material, inte inuti
[kohesiv]) attraherande kraft:
Grundsambandet
man framställer som specifikt samband för just van der Waals intermolekylära
kraftsamband, E/D0A=F/A=H/24πD03 beskriver tydligen entydigt — här i erinran med direkt
analogi till Grundämnesmetallernas
brotthållfasthet — ett
materials brottgräns. Speciellt förtydligat enligt Järnexemplet
F/A = Rm
= H(24pD03)–1
.......... N/M2
= 4 T8 Pa
= 400 MPa ............... Brottgränsen för Järn [SIS 07 17-02]
H = 12,3532 t20 J ....... Hamakers konstant
H = Rm(24pD03)
........... D0 ~ 0,16 nM =
1,6 t10 M
= Rm(3,08831 t28
M3) ;
Rm = H/(3,08831 t28 M3) Pa ;
D0
= 0,16 t9 M ;
= 1,6 Å .................... (tvärsnittsradien för
interatomära växelverkan — grovt roten ur medelatomavst.)
OM endast brottgränsen räknas (Rm) kan exemplet enkelt
utsträckas till godtyckliga ämnen — för jämförelse. Koppar, till exempel (grovt
Rm mellan 200-450 MPa), kan också uppvisa järnets brotthållfasthet. Med
gränserna 200-450 MPa skulle motsvarande H-gränser bli 7,7 till 13,9 t20 J.
Jämför uppgiften för Koppar (Cu, sist) i första tabellen i HamakerExemplet: 11 t20 J.
Resultatvärdet ovan är relevant — i Den aktuella webbkällans ljus.
van der Waalskraften F/A=K/d³ är — alltså och tydligen rent logiskt — kohesiv — medan den moderna
akademin litterära fackverk tycks beskriva van der Waalskrafterna K/d³ som
adhesiva [‡]
Resultatbilden endast understryker det redan
sagda i Kovalenta
allmänna atombindningsformen: Grundkemin [materialläran] i MAC är — tydligen — INTE
välformulerad.
Därmed
(återigen) sagt: materialets maximalt sammanhållande styrka kan bara
återföras på en inre (Den innersta) sammanhållande kraft — inte en yttre.
M.a.o.: van der Waalskraften är — rent logiskt — kohesiv. Inte adhesiv. För
grundbegreppen, se Adhesion och Kohesion.
Van der Waalskraftens avtagande med
distansen får således med ovanstående utläggning, t.ex. för metaller, ingen
annan direkt innebörd än den som (t.ex.) sammanhänger med tillförande av värme
(längdutvidgningskoefficient, generellt volymutvidgningskoefficient); Metaller
som dras till brott (med försumbar värmetillförsel) bibehåller sin
masstäthet utan att ändra atommedelavstånden.
Beträffande Hamakers konstant (H): Man kan enbart för en översiktlig vy
utgå ifrån H — webbkällor finns med tabeller, men med OBS [se även i HamakerExempel] delvis relativt stora skillnader beroende på
materialväxelverkan — eller som ovan beräkna H direkt från brottgränsen (Rm).
H-värdet ligger i vilket fall (grovt, se Tabell) i området 0,05-40 t20 J) för metaller och flytande
ämnen.
Ingen exakt (säker) beräkningsform är (ännu) känd för H;
”The
Hamaker constant is a force constant used for describing the van der Waals
(vdW) force. The magnitude
of the Hamaker constant reflects the strength
of the vdW force between two particles, or between a particle and a substrate.
It depends on the material properties of both the interacting bodies and the
intervening media. More accurate calculations of Hamaker constants require a knowledge of the dielectric
and optical properties of the interacting materials over the entire frequency
range in the electromagnetic spectrum. In
general, this information is not
readily accessible.”,
PHARMA
HUB —
http://pharmahub.org/resources/206
(Otillförlitligt
webbställe — ger Googleträffar med URL som sedan i efterhand inte kan nås
separat via separata URL, se exemplet http://pharmahub.org/resources/250/download/hamakerconstant_data.pdf) — Test på annan webbläsare visar OK [2010-10-20]: Mozilla OK,
Flock OK, Opera OK, Netscape OK, Arora notOK, Google Chrome OK. Alla
OK utom Internet Explorer 7 och Arora. Explorer 8 ej testad. [Förslag till
Världssamfundet: uteslut Microsoft Corporation: företaget åsamkar [alltmer] mer skada än nytta].
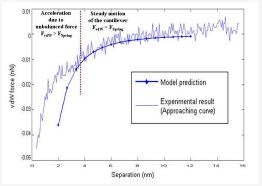
Källan påstår i vilket fall att mätningar har
genomförts [grafen ovan].
Källan ger ingen källredovisning till figuren
— inte ens typen, om det är Platta-Platta eller Platta-Sfär [orden Plate eller
Sphere finns inte ens med i artikeltexten].
Jämförelsens grunder
TNED-MAC — Casimireffekten — Adhesionsfysiken —
momenten föregående kemisk förening
ENDAST
PARALLELLA PLANA ELEKTRISKT OLADDADE PLANYTOR RÄKNAS
Jämförelsens grunder
GRUNDANALYSEN
HÄR BERÖR enbart TYPEN PLATTA-PLATTA
Figuren
nedan [även i CasimirInledning] klargör grunden för att en jämförelse MAC-TNED i
ämnet Casimireffekten alls ska vara meningsfull:
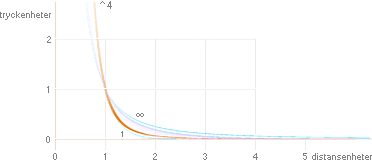
^4-grafen tillhör MAC-Casimirsambandet.
Graferna markerade 1 | ∞ tillhör TNED-sambanden. Sambandsformerna i figuren
beskrivs mera utförligt i CasimirInledning. Vi förutsätter den kännedomen här.
Med TNED-exemplet
Järn (26Fe56) vid rumstemperatur och normaltryck gäller från Kalkylkortet
distansenheten ..................... 12,20935 nM=t9M
tryckenheten
....................... 54 334
Pa=N/M²
:
Tillsammans
med de i MAC vanligt
förekommande fenomenformerna — van der Waals
krafter som anses övergå i Casimirkraften,
Casimirgraferna — Jämförande intervall
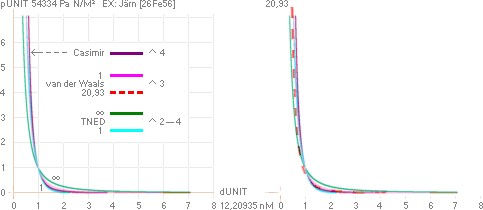
![]()
med
exempelintervall från MAC (godtyckligt från
webben, infällda ovan vä.und.; 1 ~10 nM) — referenserna
MDPI
—
EFFECTS
OF VAN DER WAALS FORCE AND THERMAL STRESSES ON PULL-IN INSTABILITY OF CLAMPED
RECTANGULAR MICROPLATES — Batra et al., 2008
http://www.mdpi.org/sensors/papers/s8021048.pdf
s1053|6:
0,5
nM - 4 nM 1/z3 ............................ van der Waals [ytor med Guld över
Aluminium]
4 nM - 1
µM 1/z3–4
......................... van der Waals — Casimir
1 µM - 1/z4
............................ Casimir
och
The
American Physical Society —
INFLUENCE
OF ULTRATHIN WATER LAYER ON THE VAN DER WAALS/CASIMIR FORCE BETWEEN GOLD
SURFACES —
Palasantzas
et al., 2009
http://eprints.eemcs.utwente.nl/17173/01/Influence_of_ultrathin_water_-_Vitaly_-_dec_09.pdf
Källan avhandlar tyvärr endast typen Sfär-Platta.
:
-
10 nM 1/z3 ............................ van der Waals dominerar
10 nM
- 0,1µM 1/z4
......................... Casimirkraften mycket
stark
— är
det FÖR DET FÖRSTA tydligt att MAC-Casimirsambandet från dUNIT=1
[mörkvioletta delen ovan mellan 0-1] helt bortfaller ur fysikbilden [Se även Jämförande funktionsgrafer MAC-TNED för Casimirsambandets
fysik]:
MAC-Casimir-delen
—
från 10 nM och ner mot 0 (atommedelavståndet ca 2,5 Å = 0,25 nM [eller konv. motsv. cutoff distance ca 0,16 nM]), i stort [som i Järnexemplet ovan] mellan
horisontalvärdena 1 och 0
— når materialets brottgränsvärde (Rm) innan
ens materialets atommedelavstånd uppnås mellan de idealt parallella
ytplattorna. Det utesluter MAC-Casimirformen som sådan — i den delen,
0-10nM.
FÖR DET ANDRA — genom att TNED-sambandet
för atomattraktion (1/ax2–4) alltmer närmar sig
MAC-Casimirsambandet (1/ax4) då separationsavståndet växer
och därmed skillnaden mellan dessa AV PRINCIP blir alltmer försumbar —
bortfaller också HUVUDDELEN AV DET ÖVRIGA INTERVALLET I VARJE RELEVANT
PRECISERAD JÄMFÖRELSE: Med Järnexemplet ovan: vid d=5,3(dUNIT)=70
nM är [TNED–MAC]/pUNIT=1% [Beräkningar i Kalkylkortet], och vilken differens härifrån blir alltmer obetydlig
med växande d.
Det
betyder med andra ord att vi i den övergripande jämförelsen HELT kan bortse ifrån
alla — samtliga — experimentella undersökningar i intervallet från runt 70 nM
och uppåt (vilket
också verkar tillhöra allra största typen redovisade experiment) — resultatet matchar i vilket fall TNED-sambandet med hög noggrannhet [Direktträff bättre än 99%]. Det
finns, för översikten, ingenting att hämta i den delen.
Det jämförande område MAC-TNED vi ska koncentrera oss på för att hitta
avgörande bevis för|emot blir alltså av typen 0-5(dUNIT) ~ 0-70 nM — med
MAC-Casimirsambandet uteslutet 0-1(dUNIT) ~ 0-10nM som ovan på grund av Rm-villkoret.
OM MAC-Casimirsambandet har någon ställning alls i den praktiska fysiken, står
alltså avgörandet helt för Casimirsambandets konventionella form i intervallet
runt 10-70nM. Det är också ungefär vad den andra källan ovan anger (Palasantzas
et al., 2009): ca 10-100 nM.
— Men
(frågar någon, självklart), om man tar bort Casimirdelen mellan 0-1, hur
förklaras då den delen i MAC, alltså det faktum ATT det även förekommer materialattraktioner
(konv. adhesion) i det intervallet.
— Van der Waals krafter fyller ut tomrummet. Jämför några av citaten i VdWCasimir
som förklarar den fysiska samhörigheten van der Waal-Casimir. Se även i Övergången Casimir-VdW.
— I TNED är
förklaringen (delvis) en annan [Se även i Förklaringen]:
TNED:
— Van
der Waals krafter (ofta konv. förk. VdW) är tydligen FASTA, inre
molekylära-atomära kohesionskrafter [inre
sammanhållande, se inledande beskrivning i Kovalenta Allmänna Atombindningsformen]: Toppvärdet för VdW/M² [F/A=H/24πd3]
är detsamma som det materialets brotthållfasthetsgränsvärde (Rm):
den maximalt sammanhållande kraften. I järnexemplet ovan blir [med typen SIS 07 17-02, ref.
MATERIALLÄRA (Karleboserien 5 1980 s205 Tabell
7.2 Segjärn] brottgränsen 400 MPa = 4 T8 Pa (1Pa=1N/M²). Det BLIR med
andra ord i den terminologins ljus VdW-kraften som definierar sammanhållningen i
atomer och molekyler i ett ämne.
VdW-kraften kan bara ändras genom att
energi(medel)vägen mellan atomer-molekyler ändras, och den ändringen kan bara
ske genom tillförande eller bortförande av värme (E=hf).
Att åstadkomma ett BROTT i ett material
genom att t.ex. utsätta det för dragspänning (eng. tension, stress)
innebär i sig ingen ändring av atommedelavstånden. Därmed framstår
VdW-krafterna som låsta — spärrade vid varje given temperatur.
— Men
vad betyder då det faktum att man använder VdW-samband för att uttrycka den
s.k. adhesionen (attraktionen mellan olika materialdelar), typ F/A=1/ad3.
Vad är det?
— TNED. Det —
F/A=1/ad3 — är ett »substitut» för TNED-formens generella
funktionstyp F/A=1/ax2–4; funktionen går kontinuerligt från
1/ax2 till 1/ax4. Se utförligt från CasimirInledning, samt blockbeskrivningen (förklaringen) i Kovalenta
Allmänna Atombindningsformen.
— Och
det är du säker på?
— Jag
SKULLE säga: »Nej. Ingalunda. Men det är det som står på bordet till prövning».
— Men
genom sambandsformerna till Grundämnesmetallernas
brotthållfasthet, se från Diagram Rm2,
är resultatbilden redan stadfäst; van der Waals kraftsamband, typen F/A=K/d3,
sammansmälter definitionsmässigt — kvantitativt och kvalitativt, se den korta
inledande beskrivningen i Kovalenta
Allmänna Atombindningsformen
— i samma resultatbild. Därmed utesluts automatiskt den konventionellt
tolkade [‡] van der Waalsformens adhesiva koppling: sambandsformen
F/A=K/d3 kopplar inte adhesivt utan kohesivt; Sambandsformen
F/A=K/d3 är alldeles tydligt tveklöst helt säkert ett substitut
i MAC.
Se även grundbegreppen Kohesion och Adhesion om ej redan bekant.
— Man
TROR (konv.) att VdW-funktionen ansluter till »en SLAGS variabel VdW» (därför att man inte har något annat
att välja på) — medan sanningen i själva
verket (här till
prövning) är den att det finns ett
ANNAT, långt mera klargörande samband som beskriver det verkliga praktiska
fallet — och som här skulle vara TNED-formen.
Det är vad som ska bekräftas eller
dementeras.
— TNED-formen med F/A=1/ax2–4 inbegriper nämligen
det som inte omfattas i MAC: Kallfogning (eng. Cold Pressure Welding): Att genom mekaniskt
TRYCK åstadkomma en fullgod materiell förening — vilket kräver runt (minst) 5-10
ggr det uppnådda TNED-trycket vid idealt noll närliggande materialytor (uppnått
atommedelavstånd) som förts ihop separat utifrån. Se utförligt i KALLFOGNINGSGRÄNSER. Se även mera ingående från VAN DER WAALS KRAFTER.
— TNED-formen beskriver adhesionen — mellan materialdelarna —
medan VdW — som ovan enligt TNED — beskriver kohesionen — inuti materialet. Casimirsambandets konventionella
form har med andra ord och i termer av TNED ingen teoretisk grund: det
ersätts helt av TNED-Casimir-formen.
I
mera förtydligad vertikal logaritmisk
skala, tillsammans med de i MAC vanligt förekommande
fenomenformerna som ovan — van der Waals krafter som anses övergå i Casimirkraften
— gäller följande mera klargörande översikt HÄR TILL fortsatt PRÖVNING:
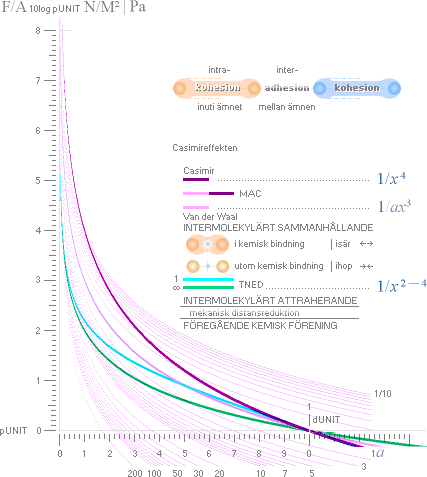
ARBETSFORMCasimirGrafUnit50 y=1[(ln[([x/5]'–2)([(x/5)'1]'–2)])/ln10]+0([ln[(1/a[x/5]'3)]])/ln10
——————————————————————————————————————————————
ALLA METALLER (till att börja med) uppvisar
brottgränser (Rm) som ansluter till a-värden grovt från a=20
och uppåt. Ämnen med exceptionellt höga brottgränser [typ GLAS] har lägre
a-värden (mot 1).
KURVFORMERNA
gäller
direkt för metallerna (relativa dielektricitetstalet εr lika med 1).
För andra ämnen gäller (nominellt): Alla
samband reduceras i vilket fall gemensamt med värdet på εr [vilket betyder att
kurvkonceptet ovan också kan användas direkt men med reducerat tryckvärde:
(blå)grönkurvan endast nivåsänks med faktorn εr].
UNDRE
ljusvioletta KURVSKARANS KOEFFICIENTVÄRDEN motsvarar a-koefficienten i van der Waals kraftsamband F/A=1/ad³. a-värdet
beräknas [utförligt i HamakerBrottgränsen] a = (dUNIT)³(pUNIT)/[H(0,0375131)] med Hamakers konstant H=Rm(24πD03) [Se Hamakerkonstanten från Rm] med D0 [Se CutOffDistance] konv. 0,165-0,185 nM,
här med förtydligande [Se Elastiska separationstrycket] D0=dATOM/√2.
TILLÄMPNINGEN KRÄVER ETT KALKYLKORT för att läsaren ska
kunna hänga med i beräkningsexemplen — Kalkylkortet innefattar en (liten, automatiserad) tabell
med grundparametrar för de förekommande ämnena.
PROBLEMET
MED TILLGÄNGLIGA WEBBREFERENSER I ÄMNET är att man för det första sällan
preciserar ämnessammansättningen — den är helt avgörande för att kunna jämföra med
TNED (medan
specifika materialparametrar inte alls finns med i Casimirformen). För det andra ligger de allra flesta forskararbeten
(för att inte säga uteslutande alla vilket här baseras på genomläsning av en stor mängd
webbdokument i ämnet) i Casimireffektens
ljus på typen Platta-Sfär-experiment — vilket är helt värdelös information i
det här sammanhanget: Ämnets grundfysik gäller (idealt, så långt det går)
plana, parallella materialytor. Det finns (här veterligt, ännu Okt2010) inga
sådana — redovisade, gratis tillgängliga — forskningsrapporter.
Jämförande exempel
National Laboratories
Det
närmaste vi kan komma (Okt2010) är den här (skärmdump, förminskad) —
typexempel:
SANDIA
NATIONAL LABORATORIES — New Frontiers in Casimir Force Control —
SURFACE
FORCES IN MEMS – ADHESION AND FRICTION EXPERIMENTS — Maarten P. de Boer 2009
http://cnls.lanl.gov/casimir/PresentationsSF/Maarten%20de%20Boer.pdf
Slide15:
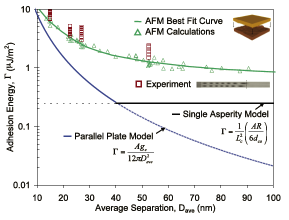
Källan anger för Platta-Platta energisambandet
(T)=Age /12πDave2 med vertikalskalan i Adhesion Energy (T) µJ/M².
Division med x-variabeln [t6/t9=1000] ger
motsvarande vertikalskalan i 1000 N/M².
Materialets sammansättning framgår inte av
källan [man får gissa].
—
Källan redovisar ingen materialsammansättning, inga koefficientvärden: Kan inte
användas.
Grafbilden
ansluter visserligen I PRINCIP till TNED-formens jämförande motsvarighet:
Men
då källan inte ger några precisa data, kan heller ingenting säkert sägas.
Teoretiska MAC-sambandet [F/A=H/ad3] [ovan
illustrerat till principiell jämförelse med a=2] ger, verkligen de
typiskt lägre värdena medan den gröna TNED-kurvan med sina typiskt högre värden
i det aktuella intervallet ser ut att passa in på webbkällans experimentellt
antydda typ [enbart
principen att en undre skär en övre, tangerar just TNED-formen].
— Det
är således EMELLERTID vanskligt att göra den jämförelsen (direkt)
eftersom webbkällan dels inte redovisar ämnessammansättningen (man får gissa ämnets
medelatomladdning, medeltäthet och brottgräns), och heller inte ens antyder något värde på Hamakerkonstanten, samt att termerna generellt inte alls förklaras i
källan. [Dvs., källuppgifterna är i princip värdelösa].
— På
sin höjd: En (vag) indikering. Inget mer.
— Men
vi skulle behöva just den ovanstående typen av jämförande grafer — MED
utförliga materialdata.
— Men
det finns, tydligen, inga sådana.
—
Ovanstående är hittills (Okt2010) det närmaste (vilket är urdåligt med tanke på
den närmast enorma uppsjö av avhandlingar som finns i ämnet — hundratals
Casimir-van der Waals-avhandlingar på webben).
—
Inte förrän experimentella data på typen Platta-Platta (som ovan) kommer fram i mera ordnad form finns någon möjlighet att avgöra vad som gäller: TNED eller
inte.
PRAKTISKT EXEMPEL MED KOPPAR
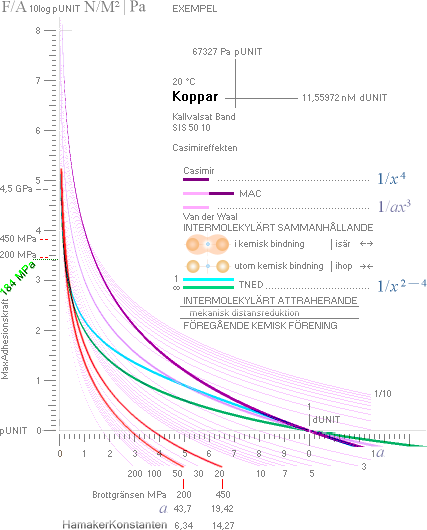
Röda
kurvorna: van der Waals kohesionskraft [ljusvioletta kurvskaran] med varierande
atommedelavstånd enligt F/A=H/ad³ med resp. a=43,7 och a=19,42 för
motsvarande brottgränsvärden 200 MPa och 450 MPa. Adhesionskraftens maxvärde [gröna
grafen]
vid nollavstånd mellan idealt plana materialplattor blir F/A=184 MPa enligt TNED-sambandet. För Hamakerkonstantens beräkning, se Hamakerkonstanten från Rm. Alla beräkningar i Kalkylkortet. MAC förkortar Modern
ACademy.
Om
man — till konkret prövande exempel — konsulterar det tillgängliga utbudet av
teorier och experiment (Okt2010) på området MAXIMAL ADHESIONSKRAFT MED
NOLLAVSTÅND MELLAN PLANA MATERIALPLATTOR FÖR kallvalsad band- KOPPAR
[SIS 50 10] vid rumstemperatur (20 °C) är det närmaste man kommer en hänvisning
till van der Waals samband F/A=H/ad3, se ovanstående bägge röda
kurvdelar för respektive brottgränserna 200 MPa och 400 MPa. Med andra ord: inget bestämt
värde existerar: ingen
teoretiskt bestämd matematisk sambandsform existerar: ingen teori finns. TNED-sambandet däremot [gröna kurvdelen] garanterar
alltid en lägsta nivå genom SKÄRNINGEN mellan funktionstyperna 1/d2
och 1/ad3 och som garanterar att max adhesion (1/d2)
alltid ligger under brottgränsen (1/ad3). Det konventionella
Casimirsambandets form (1/d4, violetta grafen) självutesluter
sin teori i praktiken genom att brottgränsvärdet nås långt innan ens
atommedelavståndet har tangerats. Casimireffekten i konventionell mening är
därför helt säkert utesluten som fenomenform i intervallet närmast materialens
naturliga atommedelavstånd (och upp till i varje fall ca 10 nM).
Van
der Waals-kraften för materialtes brottgräns (Rm)
— f.ö. den enda kvantitetsmatematik som finns på området i MAC — kan NÄMLIGEN inte servera
kriterium för max adhesionskraft då två separata materialplanplattor har förts
ihop med nollavstånd emellan, eftersom det krävs (MINST) 5-10ggr Re-värdet i
KALLFOGNING
för att uppnå kemisk bindning till Rm-status.
Vilket vill säga:
Maximalt adhesionstryck (alla fasta ämnen)
ligger alltid under, lägre än, materialets brottgräns (Rm);
Van der Waals
kraftsamband beskriver följaktligen ingen reguljär adhesionsfysik, utan tydligen en ren kohesionsfysik:
materialets inre maximalt sammanhållande kraft och som bara kan ändras med
ändrade atommedelavstånd, analogt TEMPERATURÄNDRINGAR.
TNED-sambandet
[1/x2–4] — som här till prövning, HELT ersätter det
konventionella Casimirsambandet [1/x4] — innefattar tydligen
hela intervallet (0→∞) med alla faser i adhesionsfysiken, från
minimala atommedelavståndet (idealt parallella atomplan, nollavstånd mellan separata planplattor), och vidare ut till maxgränsen (som bestäms av två
närliggande materialytor), och ger därmed via nollavståndet materialets
maximala adhesionskraft — alltid under brottgränsen Rm
för fasta ämnen, eller ska i varje fall göra det för logisk praktik.
Enda PROBLEMET är
1.
svårigheten att BEKRÄFTA SAMHÖRIGHETEN; Experimenten görs (uteslutande,
Okt2010) med Sfär-Platta eftersom Platta-Platta-experimenten tydligen övergår
experimentatorernas förmåga — med tillhörande teoretiska komplikationer som
bara gör ämnet ännu mera komplicerat och svårbegripligt när det kommer till
redovisning av mätresultat;
2.
bristen på material- och koefficientredovisning i det material som faktiskt
finns: TNED-sambandet (vid rumstemperatur) bygger helt på precisa
materialparametrar [täthet, atomnummer (medelnuklidladdning för sammansatta
ämnen), medelatomvikt, brottgräns], men ingenting sådant finns ens med i
den konventionella Casimirteorins grund (inte ens ämnets täthet),
varför heller knappast några materialparametrar redovisas alls i någon mera
precis mening i de konventionella rapporter som finns.
Se till jämförelse Jämförande Exempel National Laboratories.
Webben är med andra ord (Okt2010) praktiskt
taget helt ren på Platta-Platta-referenser till jämförelse i det avgörande
intervallet 0,1-100 nM.
[Konventionella
Casimirsambandet och TNED-formen skiljer sig allt mindre från ca 70 nM (skillnaden mot
tryckenheten är 1%, sedan avtagande) och uppåt och det intervallet blir
därför mindre intressant i bevisningen].
Se även citat i CasimirRef
som ytterligare understryker bristen på klarhet i ämnet.
Van der Waals krafter inom kemin
Citaten
nedan avspeglar det som
uppmärksammat den här presentationens
andemening — avsaknad av enhetlighet och entydighet i grundbegreppen i MAC, speciellt
beträffande de materialsammanhållande krafterna och deras matematiska form.
Se
särskilt komprimerad exemplifierad form i Grundämnesmetallernas Brotthållfasthet.
GENOMKOLL
2010-10-26:
Med följande repertoar är det inte underligt om kemistudenten
blir (något) förvirrad:
”Intermolecular forces are relatively weak forces between molecules
or between different
chemical groups of the same large molecule which act
at the distances of Van der Waals radii or
larger. This is in
contrast to chemical bonds which are stronger, act at the shorter distances, and are formed between different atoms of
the same molecule.”,
@INTERNET
Wikipedia Intermolecular force 2010-10-26
http://en.wikipedia.org/wiki/Intermolecular_attraction
:
intermolekylär
kraft ............. svag, van der Waals
kemisk
bindning ................... stark (elektrisk)
”In
physical chemistry, the van
der Waals force (or van der Waals
interaction), named after Dutch scientist Johannes Diderik van der Waals, is
the sum of the attractive
or repulsive forces between molecules (or
between parts of the same molecule) other than those due to covalent bonds or to the electrostatic interaction of ions
with one another or with neutral molecules.[1]”,
”Van der Waals forces include attractions between atoms, molecules, and surfaces. They differ
from covalent and ionic bonding in that they are caused by correlations in the fluctuating polarizations of nearby particles (a consequence of quantum dynamics[2]).”,
@INTERNET
Wikipedia van der Waals force 2010-10-26
http://en.wikipedia.org/wiki/Van_der_Waals_force
:
interatomär
attraktion ........... van der Waals
”A chemical bond is an attraction
between atoms or molecules that allows the formation of chemical compounds, which contain two or more atoms.”,
”A chemical bond is the attraction caused by the electromagnetic
force between opposing charges, either
between electrons and
nuclei, or as the result of a dipole attraction.”,
@INTERNET
Wikipedia Chemical bond 2010-10-26
http://en.wikipedia.org/wiki/Chemical_bond
:
kemisk
bindning .................... elektrisk attraktion mellan atomer — ELLER
molekyler
Citatblocken tränger TYDLIGT in över varandras
gränser — så att den beskrivna gränsdragningen TAGET GENERELLT SOM ETT
ENHETLIGT LÄROSYSTEM framställer bilden av ett system som saknar entydighet:
formuleringarna GENERELLT avspeglar ett tydligt kaos.
FÖRMODLIGEN
är anledningen till ovanstående (milda) kaos den att det inte är enkelt att
klassificera materialstrukturen — när man inte har koll på vilka komponenter
som ingår i fysikbilden : elektronmassans komponenter.
;
TILL
VISS DEL säger källorna ovan så här (men det finns ingen etablerad källa som
utsäger det tydligt — därför att ämnet innefattar elektronmassans komponenter —
som bannlystes från 1927):
— ALL
materialsammanhållning definieras krafttekniskt av van der Waals allmänna kraftsamband F/A=H/ad3: materialets brottgräns (Rm):
materialstyrkan eller den internt sammanhållande kohesionskraften (intermolekylärt
eller interatomärt
sammanhållande materialkraft).
—
Atommedelavståndet (d) kan bara ändras med ändrad energimedelkraftväg
(via E=hf), och den kan bara ändras genom ändrad temperatur. I —
inuti — kohesionsstrukturen finns en (stor) mängd olika samverkande aspekter på
kraftbildning som alla arbetar efter en och samma gemensamma princip: resonansverkan:
Vågmönster, vågkopplingar, förskjutningar, fasvridningar, skärmningar,
bandförstärkningar, dipolsvängningar (konv. ofta Londonkrafter).
— Att
DÄRFÖR påstå att van der Waals kraftverkan inuti ett material SKULLE vara av
typen ’svag kraft’ motsäger själva provstavens eget brottgränsvärde (Rm)
som säger att van der Waalskraften är den ENDA sammanhållande kraft som alls
finns i materialet, och utöver den, ingen alls. Med andra ord i praktisk mening: typen ’kemisk bindning’ — den interna kraftverkan
mellan (d) olika atomplan i ett material (ideal kristall) vid given
temperatur — är van der Waals kraft, F/A=H/ad3.
Se HamakerExempel med olika konstanter — Konstanten H är (ständigt) föremål
för olika mätningar-beräkningar (med stundtals rätt stora olikheter beroende på källverk); Med referens till de relativa marginalerna är det
alldeles tydligt att sambandet mellan Hamakers konstant (H) och brottgränsen (Rm) är linjär (direkt proportionell). Se Hamakerkonstanten från Rm.
För vidare.
PÅ
WEBBEN
GRUNDBEGREPP
INTERMOLEKYLÄRA
KRAFTER — GRUNDBEGREPP, grundsamband
”Smooth
surfaces of mica, gold, various polymers and solid gelatin solutions do not
stay apart when their separating becomes small enough – on the order of 1-10
nm. The equation describing these attractions was predicted in the 1930s by De
Boer and Hamaker [2]:
P –A
——— = —————— Where
area (24π z3)
P is
the force (negative for attraction), z is the separation distance, and A
is a material specific constant called the Hamaker constant.”,
@INTERNET Wikipedia Adhesion 2010-10-21
http://en.wikipedia.org/wiki/Adhesion
”For
example, the van der Waals adhesive force between two flat plates of equal interfacial area A and uniform separation zsep
is [1152]
H A
FvdW =
—————— {Eqn. 9.6}
24π zsep3
”,
ref. 1152.
Kevin Kendall, "Adhesion: Molecules and Mechanics," Science 263(25
March 1994).,
Institute
for Molecular Manufacturing —
NANOMEDICINE, VOLUME I: BASIC CAPABILITIES —
Robert A. Freitas Jr, 1999
http://www.nanomedicine.com/NMI/9.2.1.htm
PRIMÄRDOKUMENT I GRUNDTEORIN FRÅN 1957 i
Royal
Society — DIRECT MEASUREMENT OF THE
LONG-RANGE VAN DER WAALS FORCES — J. A. Kitchener, A. P. Prosser 1957
http://rspa.royalsocietypublishing.org/content/242/1230/403.full.pdf+html
Ingen direkt tydlig sambandsform ingår för
jämförelse.
Dokumentet avhandlar tidiga mätningar av van
der Waals kraftverkan mellan glasplattor i intervallet 0,7-1,2 µM.
Dokumentet använder [de äldre fysikaliska
enheterna]
enheten dyn: 1N = T5 dyn [ref. @INTERNET Wikipedia Dyne 2010-10-23]; 1dyn = t5 N;
enheten erg: 1erg = 1dyn·1cM = (1 t5
N)(0,01M) = 1 t7 J; 1 J = 1 T7 erg.
tydligt
illustrerad:
rubrik|författare|källa|datum
SAKNAS
http://www.vigoschools.net/~mmc3/org%20lecture/Unit%201%20-%20Chemical%20Bonding%20-%20Ch%203,4/L6%20-%20Intermolecular%20Forces%20of%20Attraction%20-%20Ch%204.pdf
tydligt
illustrerad, delvis samma som ovan (men betydligt snabbare nerladdning):
INTERMOLECULAR
FORCES — Department of Chemistry, Pima Community College — David A. Katz (datum
saknas)
http://www.chymist.com/Intermolecular%20forces%202010.pdf
En
(av få källor) som ger kvantitativa/matematiska samband i ämnet Intermolecular
Forces,
University
of Washington — INTERMOLECULAR AND
SURFACE FORCES — René M. Overney (2000)
http://courses.washington.edu/overney/ChemE554_Course_Mat/course_material/surface_forces.pdf
”The attractive van der Waals force between
the atoms is proportional to 1/r7,
where r is the distance between the atoms.”.
;
Källan
ovan täcker en beskrivning av intermolekylära kraftsamband och referenser i
området (0,1) -10nM med (relativt) utförliga beskrivningar — men källan ger bara delvis referenser. För en fullständig bild behövs ytterligare
källdokument. Se även Hamakers konstant.
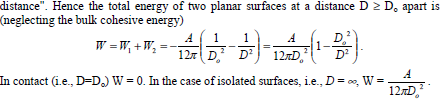
s16ö
(Hamakerkonstanten här betecknad A):
Ytterligare
en utförlig (colloid, sv. limlik):
E-book
— CRC Press
COLLOID
INTERACTIONS AND COLLOID STABILITY — John Gregory 2006
http://www.crcnetbase.com/doi/pdfplus/10.1201/9780203508459.ch4
Källan ger mera vidlyftiga samband för
Hamarkonstanten via Plancks konstant, medelgenomströmningsfrekvenser, och
medelbrytningsindex, s71.ekv.4.11
![]()
Eller, om materialen är lika ekv.4.12,
![]()
Källan ger för Vatten [s70 Table 4.1 via
4.12 ovan] värdet 3,9 t20 J — utan någon specifikation av temperatur. Jämför brottgränsvärden för vatten vid olika temperaturer —
tillsammans med en möjlig koppling mellan Hamakerkonstanten-Rm, se Hamakerkonstanten från Rm.
Jämförelsen endast understryker DIVERSITETEN i komplexet generellt —
generellt SVÅRIGHETEN att (ens försöka) beräkna ”exakta materialparametrar”.
[Pröva gärna — men inbilla dig ingenting].
Hamaker constant — Hamakers konstant
Hamaker
constant (efter H. C. Hamaker 1937) — Se
även Innebörden av
Hamakers konstant
Hamakerkonstanten [H] ingår i van der Waals
kraftsamband som F/A=H/ad³.
Se även Hamakers konstant från Rm.
Tabell med värden för ämnen i flytande och
fast form (0,057 - 40):
University
of Washington — HAMAKER CONSTANT AND ITS
LIFSHITZ MEAN FIELD REPRESENTATION
http://courses.washington.edu/overney/Material/HandoutsChemE498/Hamaker_Constant.pdf
Tabell:
s4Table1
— Koppar: i vakuum 40 t20 J; i vatten 30 t20 J,
FORCES
ANALYSIS FOR MICROMANIPULATIONS IN DRY AND LIQUID MEDIA — Gauthier et al.,
2008
http://hal.inria.fr/docs/00/26/44/38/PDF/JMM06_LAB_LRP.pdf
Mera
omfattande tabell (flera på fasta ämnen, som Silver och Koppar):
PHARMA
HUB — Collaboration for Pharmaceutical engineering and science — (författare,
datum saknas)
http://pharmahub.org/resources/250/download/hamakerconstant_data.pdf
Kan
inte åtkommas med separat URL — källan kan inte åtkommas genom diskreta URL —
tydligen privat domän;
— Test på annan webbläsare visar OK
[2010-10-20]: Mozilla OK, Flock OK, Opera OK, Netscape OK, Arora
notOK,
Google Chrome OK. Alla OK utom Internet Explorer 7 och Arora. Explorer 8 ej testad.
Åtkomst
via Google nedan
:

Uppgifter på vattnets brotthållfasthet (eng. [Ultimate] tensile strength) finns på
GOOGLEBÖCKER
s14 Figure 1.3
Sonochemistry
and cavitation — M. A. Margulis 1995
Figuren ger en graf med nära linjärt stigande vänsterflank
från vattnets fryspunkt (278 °K) och nära 0 MPa [med en mellanliggande
brytpunkt vid ca 27 MPa och 282 °K] upp till en rundning vid nära 30 MPa (28,44
MPa) och 286 °K, sedan långsamt neråt igen nära linjärt till strax över 20 MPa
vid drygt 320 °K.

Cut-off distance — ’0,165-0,185 nM’ (1,65-1,85 Å), ofta D0

;
GOOGLEBÖCKER
s51
Polymeric
nanocomposites: theory and practice —
Bhattacharya et al., 2008
Cut-off-distansen
diskuteras särskilt sidan 16 i Washingtonkällan — men med utflykter som av läsaren förmodligen kräver
meriter på nivån nobelpris. Det är (min mening) ytterst oklart vad/vilka
underförståddheter författaren åsyftar. Källan ger heller ingen vidare
referens.
Andra
källor bekräftar nominella värdet ca 0,16 nM:
s5267sp2n:
”The natural choice for d is the
nominal molecular diameter, identified with the cutoff distance in the van der Waals theory. The standard value3 is 0.165 nm.”,
Department
of Chemical Engineering —
KINETIC
SLIP CONDITION, VAN DER WAALS FORCES, AND DYNAMIC CONTACT ANGLE —
Len
M. Pismen, Boris Y. Rubinstein 2001
http://pattern.technion.ac.il/download/00/La011452s.pdf
Alla
använder termen — ingen tycks vara i stånd att förklara den.
Vanligt modernt syndrom.
”The cutoff distance criterion, while computationally efficient, has some disadvantages. The possibility always exists that the overall nonbonded interactions at long range are not negligible because
such interactions are numerous. However, the slope of the van der Waals and
electrostatic potentials in this region is small.”,
datum,
författare saknas — NONBONDED ENERGY
TERMS
http://www.biogem.org/Accelrys/Simulation/sima_minim_th_nonbonded-energy-terms.html
Problemet
är att termen CutOff Distance tydligen används i många (kemiska) tillämpningar
i samband med en (stor) diversitet av molekylära substanser — inte sällan långt
ifrån några interatomära medelavstånd (typ 7 Å och liknande).
EXEMPEL:
VATTEN
har tätheten ca ρ=m/V=1000 KG/M³;
Antalet molekyler per kubikmeter är
N = m/Uu=(1000
KG)/(H1+H1+O16=18)(1,66033 t27 KG) = 3,34605
T28;
Varje
(H1+H1+O16=18)-molekyl upptar alltså
kubvolymen
V(1)=1/N=2,98859
t29 M³;
TredjeRoten
ur V(1) ger kubsidan, analogt idealt kubiska
intermolekylära medelavståndet
dATOM = 3,10328 t10 M ~ 3,1 Å = 0,31 nM;
dATOM = [Uu/(ρV=m)]1/3
Knappast ens i flytande ämnen är molekyl-
eller atommedelavstånden större än runt 3Å. [grovt 2,5Å för fasta ämnen].
I varje fall om ämnet berör MATERIALENS
HÅLLFASTHET (den
sammanhållande kraftytan) räcker det
inte att sväva ut i sådana oklarheter typ ’7Å’ om ämnet gäller att försöka klargöra
vad termen cutoff distance står för,
eftersom vi redan VET att den molekylära kedjelinjens inneboende styrka står
och faller med den sammanhållande kraften mellan närliggande ATOMER (typ 2,5Å)
i en molekyl, vilkensom.
Det blotta faktum att ingen (vidare)
klargörande framställning (alls överhuvudtaget i webbens gratisdel) tycks
finnas på området (ännu Okt2010), bara understryker ämnesområdets kaotiska
karaktär.
van der Waals — Casimir
Casimirkraften
som den retarderade (fördröjningseffekter, skärmning, över större avstånd) van
der Waals-versionen
Se
även separat citat i Övergången VdW-Casimir.
”The
London-van der Waals forces are related to the Casimir effect for
dielectric media, the former being the microscopic description of
the latter bulk property.”,
http://en.wikipedia.org/wiki/Van_der_Waals_force
”In
fact "Casimir's original goal was to compute the van der Waals force
between polarizable molecules" of the metallic plates.”,
http://en.wikipedia.org/wiki/Casimir_effect


”Casimir
and Polder worked out the
retarded dispersion force between
molecules in 1947 [6], the
long range part of
the van der Waals force.”,
http://puhep1.princeton.edu/~mcdonald/examples/fluids/brevik_prl_82_3948_99.pdf
”The Casimir force is closely
related to the van der Waals attraction
between dielectric bodies.”,
;
”However,
in practical terms, the Casimir
and van der Waals forces are quite different; the van
der Waals force is always attractive, whereas the sign of the Casimir force is geometry dependent.”,
;
”Our
first attempts at measurements
using parallel plates were unsuccessful;
this is because it is very
difficult to maintain parallelism at the
requisite accuracy (10–5 rad for 1 cm diameter plates).”,
Notera
området — 0,5-10 µM (jämför Analysområdet):
;
”The most
striking demonstration of the Casimir force is given in Fig. 4. The agreement with theory, with no adjustable parameters, is excellent. It should be noted that the closest approach is about
0.6 µm”,
;
”In
conclusion, we have given an unambiguous demonstration of the Casimir force
with accuracy of order 5%.”,
http://web.mit.edu/~kardar/www/research/seminars/Casimir/PRL-Lamoreaux.pdf
Övergången vdW-Casimir
Hur MAC beskriver typglappet 0,1-10nM
— som
inte kan beskrivas av Casimirsambandet
i MAC
Upphittad
källa som sammanfattar (vad [vi] hela tiden uppfattat, men som
få verkar kunna formulera — att van der Waalkraftsambandet används som
brobyggare):
MDPI
—
EFFECTS
OF VAN DER WAALS FORCE AND THERMAL STRESSES ON PULL-IN INSTABILITY OF CLAMPED
RECTANGULAR MICROPLATES — Batra et al., 2008
http://www.mdpi.org/sensors/papers/s8021048.pdf
s1053|6:
”Consistent
with the parallel plate approximation for the electrostatic force, and the
small deformations assumption in the mechanical model, the distributed load due
to the Casimir force per unit surface area is given by the proximity force
approximation [44, 45], which for perfect conductors yields:
![]()
where
ħ is the Plank’s constant and c is the speed of light in
vacuum. Corrections to equation (7) for geometries with known and fixed
departures from the parallel configurations are reported in [44, 45]. For gaps
smaller than the retardation length, that is, for gaps smaller than the
wavelength of the virtual transitions responsible for the quantum dipole
fluctuations [31, 33], the
Casimir force reduces to the van der Waals distributed force per unit surface area [46–48]
![]()
In
equation (8), A is the Hamaker constant, see for example [31], with
values in the range [0.4, 4] × 10−19J.*
van der Waals and Casimir forces between parallel layered
metallic surfaces have been extensively studied in the literature, see for example [31, 33]. For gold-coated aluminum surfaces, it is found that van der Waals force, see
equation (8), is effective
in the gap range 0.5 nm − 4 nm. For gaps in the range 4 nm − 1
μm, there is a transition between the force-distance
dependence g−3 (van der Waals force) to the force distance dependence g−4
(Casimir force). For gaps
larger than 1 μm, the interaction
between the plates is described by the Casimir force, see
equation (7). Therefore, for
perfect conductors, at large separation distances the interaction force is independent of the material properties of plates, whereas, as the gap decreases, the interaction force is affected by
the material properties of the system. For
dielectric bodies, the van der Waals force is effective at larger distances as
shown in [49].
——————————
*In the literature
[31–33], the Casimir force, see equation (7), is usually termed the retarded van der Waals, whereas
the van der Waals
force, see equation (8), is called the nonretarded van der Waals. This
nomenclature better illustrates the common physical nature of these surface
forces.”.
:
0,5
nM - 4 nM 1/z3 ............................ van der Waals [ytor med Guld över
Aluminium]
4 nM - 1
µM 1/z3–4
......................... van der Waals — Casimir
1 µM - 1/z4
............................ Casimir
Källan är i övrigt fattig
på klargörande [DIREKT användbara] data — dessa ligger inbäddade i
specialtermer som också är fattiga på relaterad beskrivning [w-faktorn t.ex.].
En
annan källa ger något annorlunda besked:
-
10 nM 1/z3 ............................ van der Waals dominerar
10 nM
- 0,1µM 1/z4
......................... Casimirkraften mycket
stark
:
s1sp1mn:
”At separations below 100 nm the Casimir
force is very strong and becomes
comparable to electrostatic forces corresponding to voltages in the range 0.1–1
V,1–3 while for separations
below 10 nm the van der Waals force dominates any attraction.7–9”,
;
The
American Physical Society —
INFLUENCE
OF ULTRATHIN WATER LAYER ON THE VAN DER WAALS/CASIMIR FORCE BETWEEN GOLD
SURFACES —
Palasantzas
et al., 2009
http://eprints.eemcs.utwente.nl/17173/01/Influence_of_ultrathin_water_-_Vitaly_-_dec_09.pdf
Källan avhandlar tyvärr endast typen Sfär-Platta.
Notera
även diversiteten i utbudet av HUR van der Waals kraftekvation skrivs, se citat
i Allmänna samband.
BILDKÄLLA:
Författarens arkiv · BildS9 Excur9 · 2okt2010 · Nikon D90 · Detalj
Hållfasthet på Webben,
Grundläggande hållfasthetsbegrepp
(drag)belastningsdiagram — allmän hållfasthetslära — Rm,
brottgränsen
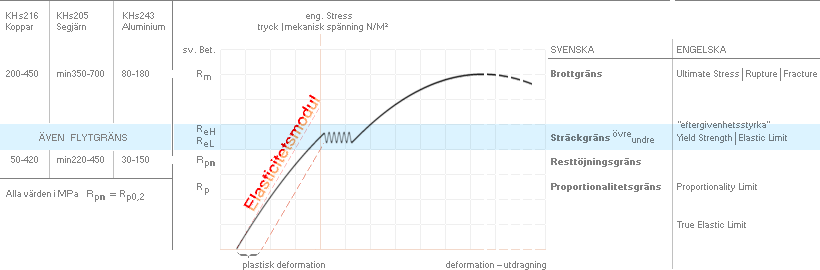
Diagramförklaringar med källuppgifter
—————————————————————————————————————————————————————————————————————
KH anger MATERIALLÄRA (Karleboserien 5 1980)
med sidangivelser. Svenska beteckningar och benämningar från KARLEBO HANDBOK
utgåva 12 1977 s197. Engelska beteckningar från Wikipedia (2010), samt ytterligare
(här utan specifik referens) (godtyckligt, synonymer) från olika webbkällor som
använder begreppen generellt. ELASTICITETSMODULENS DEFINITION från MATERIALLÄRA
(Karleboserien 5 1980) s20n. R(pn)-beteckningen med n=0,2 betyder 0,2%
kvarstående töjning (utdragning) vid den aktuella tryckkraftens-dragspänningens
belopp. Rp0,2% anges ofta (i äldre svensk facklitteratur) som
materialorienterande referensvärde tillsammans med Rm-data (med flera som inte
ingår i den enkla översikten ovan). Enheten MPa = T6 Pa med Pa = N/M².
Se
t.ex. jämförande exempelbeskrivning i webbkällan
Substances
& Technologies — TENSILE TEST AND STRESS-STRAIN DIAGRAM — 2009
http://www.substech.com/dokuwiki/doku.php?id=tensile_test_and_strain-stress_diagram
Grundbegreppen i material-hållfasthetsläran
finns också beskrivna på svenska (med delvis korsreferens för
engelska benämningar) i webbkällan
JÄMVIKT
OCH ELASTICITET, KP 12 — Sammanfattning F10, TFYA16, mekanik för TB, Carl
Hemmingsson 2007
http://www.ifm.liu.se/edu/coursescms/TFYA16/lectures/Sammanfattning-F10.pdf
Webbkällor som upplyser om
materialsammanpressning:
LOW ACTIVATION
JOINING OF SiC/SiC COMPOSITES FOR FUSION APPLICATIONS — (2007)
http://www.ms.ornl.gov/fusionreactor/pdf/Vol.47/2.5%20pp.%2042-46%20Henager.pdf
”Joining
pressure appears to require almost 30 MPa at 1673K in order to produce strong
and dense joints.”
Cold
Pressure Welding — sv., KallPressSvetsning (KallPressSammanFogning, enklare
TryckSammanfogning)
NEW
JOINING TECHNOLOGY FOR METAL PIPE IN THE CONSTRUCTION INDUSTRY — Construction
Industry Institute 2003
http://www.construction-institute.org/btsc01.pdf
s22:
”Cold pressure welding is a method of
joining sections of metal together by the application of pressure but using no heat or flux (Davies, 1993).”,
”Cold
welding uses substantial pressure at room temperature to produce joining of materials
through plastic deformation at the weld. It is of limited applicability,
however, because it requires extremely clean surfaces and high pressures and it
is difficult to accomplish consistently.”
Inga
uppgifter på tryck.
Cold
Pressure Welding — Teknik, förklaring,
historia, exempel — men utan tryckdata:
PWM —
World leader in cold weld technology — WHAT IS COLD PRESSURE WELDING? —
(2010)
http://www.coldpressurewelding.com/cms/index.php?option=com_content&view=article&id=92&Itemid=2&lang=en
”There
have been several explanations
as to the actual mechanism by which a cold
pressure weld is obtained. For example, it has been suggested that it happens
via recrystallisation or by an energy hypothesis, but most
explanations have been either experimentally disproved or refuted on
theoretical grounds.”,
”The currently accepted hypothesis that accounts for a cold pressure weld taking place involves the atoms of metals being
held together by the metallic 'bond', so
called because it is peculiar to metallic substances. The bond can be described
as a 'cloud' of free, negatively charged atoms into a unit as a result of
attractive forces.”.
Bättre
resultat i källan nedan — tryckdata ingår —
TWI —Technology
Engineering —
TWI KNOWLEDGE
SUMMARY, COLD PRESSURE WELDING, INTRODUCTION 2003
http://www.twi.co.uk/content/ksedn002.html
”All
metals are surrounded by surface layers (oxide) which must be disrupted if they
are to be welded. Cold
pressure welding, carried out at ambient
temperature, relies upon the use of high compressive pressures
[1] (1400-2800N/mm² for aluminium and at
least double that value for copper). This
provides interfacial deformations of 60% to 80% that break the oxide layers to
expose fresh, uncontaminated metal that makes contact. In this state,
interatomic forces take over to produce the weld.”.
Källan
ovan anger generellt
1
N/mM2 = 1
T6 N/M2 = 1 MPa = 0,001 GPa ;
1400
- 2800 N/mM2 = 1,4 - 2,8
GPa
Sammanfogningstryckkraften
[p(J)] ligger alltså betydligt
över materialets naturliga brottgräns [grovt 1/10 av p(J)],
eller mera rättvist uttryckt, ca 5-10 ggr elasticitetsgränsen (Re).
Se
även samma uppgifter i
Linköpings
Universitet — Institute of Technology — SIMULERING
AV KALLPRESSVETSNING — Haris Hastor 2004
http://www.solid.iei.liu.se/Publications/Master_thesis/2004/hastor.pdf
”Enligt
teknisk litteratur [14] gäller följande villkor för att kallpressvetsning av aluminium skall uppstå:
• Kontakttrycket måste vara större än 200 N/mm2 (200 MPa)
• Den
plastiska töjningen ska vara minst 40 %
”.
Redovisningen
från webbkällan ovan på materialegenskaperna (brotthållfastheten, främst, det
mest intressanta) före-efter är dock (väl) mager. Webbkällan längre ner Mahabunphachai et al., 2009 ger bättre besked
på den punkten.
minst 5-10 ggr materialets naturliga elasticitetsgräns (Re)
Källan
nedan ger både utförlig teori, experiment och analyser (se särsk. s4), även
testdata på rostfritt stål ingår (SS 316) [eng. pressure weldning, sv.
trycksammanfogning, el. trängre ’trycksvetsning’],

Journal
of Manufacturing Science and Engineering
— AUGUST 2009 —
PRESSURE
WELDING OF THIN SHEET METALS: EXPERIMENTAL INVESTIGATIONS AND ANALYTICAL
MODELING —
Mahabunphachai
et al., 2009
http://www.mdm-lab.vcu.edu/Papers/40_Published_PressWeld_ASME_v_131_n4_041003.pdf
s5sp2mö:
”Based on the results in Fig. 5, in general, the bond strength is shown to increase with increasing welding pressure up to a certain
point, after which the bond strength would decrease as higher
pressure is applied to the specimens.”,
”Therefore, there exists an optimal welding pressure and optimal reduction value where the bond strength is at maximum. This
optimal value is, however, a material-
and process-dependent parameter as shown in
Fig. 5. Unfortunately, with the selected welding pressure range in this study,
only certain cases of the optimal welding pressure values can be demonstrated.
Nonetheless, the optimal reduction point is clearly shown for all three
material types.”;
Källans använda förkortning YS = Yield Strength, s6 Fig. 5.
Yield
Strength (sv., ung.
»eftergivenhetsstyrka»), ett materials deformationsspänningsgräns, samma som
konv. sträckgräns, flytgräns eller elasticitetsgräns (Re).
Se Wikipedia Yield
(engineering). Synonymt i
engelskan används även Elastic Limit (sv. elasticitetsgräns).
Testvärdena i artikeln (YS) ligger på
69-251 MPa, Table 2 s4 med materialen Koppar-Aluminium-Nickel-Stål(SS304,
SS316, bägge av typen rostfria).
—
Figur 4 s5sp1n redovisar [”Min. welding
pressure/YS” 3,2-13,2 vs ”Thickness. t0
(micrometer)”, 50-250 µM] med förhållandet p(Jmin)/p(YS)
för både Nickel(200) och Koppar(110): bägge visar över 1 med max13,2|min4,8 för Nickel och
max9,6|min3,6 för Koppar.
— Med
andra ord: molekylär
sammansmältning från|med runt och grovt 5-10 ggr
materialets naturliga deformationshållfasthetsgräns (Re);
s4sp2n:
”Based on the results shown in Fig. 4, for the same sheet
thickness the ratio
between the minimum welding pressure to the material yield strength of Ni200 was found to be higher than that of the Cu110
(YS of Ni200=148 MPa and YS of Cu110=69 MPa), showing that Cu110 blanks are easier to bond than Ni200. On the other hand, no bonding could be obtained for SS316
and SS304 blanks (YS=251 MPa and 215 MPa,
respectively) even at the high welding pressure of 3000 MPa.”.
;
—
Molekylär sammanfogning i vanlig rumstemperatur mellan olika materialytor
förekommer med andra ord (knappast) med mindre än man applicerar minst 5-10 ggr materialets naturliga elasticitetsgräns [sträckgränsen, Re] (dvs., 5-10 ggr ×
grovt 40-400 MPa för metallerna, eller grovt runt 1 GPa).
Lawrence Livermore National Laboratory — runt 100 ggr Rm
Sökning
på webben i ämnet (Okt2010) visar (alternativ uppgift) att det krävs
runt (minst) 100 ggr normala brottgränstrycket för att få fram (eller närma
sig) motsvarande (effekter som tangerar) homogena material via artificiell
sammanpressning.
En
viss orientering ges i webbkällan
Lawrence
Livermore National Laboratory —
HIGH
PRESSURE MATERIALS RESEARCH USING ADVANCED THIRD-GENERATION SYNCHROTRON X-RAY —
Yoo et
al., 2006
https://e-reports-ext.llnl.gov/pdf/335826.pdf
Källan
berättar att det krävs runt (minst) 100 ggr mer tryck att få »molekylär
reaktivitet» än den (i
vårt exempel med t.ex. Järn) motsvarande
brottgränsens värde (0,4 GPa).
”The
products are controlled by collective behaviors of molecules, leading to strongly associated phases in a
pressure range of 10-50 GPa”,
Yoo et
al., 2006 som ovan
I Järnfallets Exempel betyder det grovt minst 40 GPa, analogt 100ggr mer än
brottgränsens 0,4 GPa.
—
Korrektheten i den förmodade iakttagelsen att det krävs extra inskjutningar för
att tangera normal materialstruktur betyder alltså för det etablerade
Casimirsambandets form uppenbarligen en motsägelse [Se även de inledande jämförande typgraferna]; Om inte sambandsformen som helhet ska förkastas, måste
den uppenbarligen avgränsas till områden som är större än (typiskt, minst) 1-2
nM; Kortare avstånd gör uppenbarligen våld på materialets naturliga egenskaper.
Se även NOTERING 3 i MAC-Casimirsambandet.
Kall(samman)fogning
Beskrivande teknisk animering finns på
Galaxy
Graphics — TECHNICAL ANIMATION OF COLD
PRESSURE WELDING — 2010
http://www.galaxygraphics.co.uk/flash/cold_pressure_welding.htm
Materialens brottgränser,
överskrids av MAC-Casimir
2010X15
TNED-Casimirvärden gränsar till materialens brottgräns
— medan däremot MAC-sambandet skjuter över målet med
stora belopp
Med normala atommedelavstånd [d=0, se Kalkylkortet] ges för Järnet (26Fe56)
TNED-Casimirvärdet 0,166 GPa — Brottgränsen för segjärn ligger vid lägst 0,4
GPa — medan MAC-sambandet ger 483,44 GPa.
Brottgränstabeller i MAC
Relativt omfattande tabell med metallernas
egenskaper [och de olika ämnenas mekaniska
(och övriga)] finns för jämförande översikter på
MATWEB,
YOUR SOURCE FOR MATERIALS INFORMATION
http://www.matweb.com/search/PropertySearch.aspx
Skriv in ämnets namn på engelska, välj sedan
från en lista med ämnets olika typer-faser-legeringar.
:
Notering 1. Inte alla ämnen har Rm-data (Kobolt, eng.
Cobalt har det t.ex. inte).
Notering 2. Brottgränsvärden kan skilja sig
(betydligt) mellan olika källor beroende på i vilken utsträckning man
preciserar materialet. Jämförelser med SIS [Sveriges
Standardiseringskommission] är inte obetingat rak.
Draghållfasthetstabell för många ämnen finns
till jämförelse i MegaPascal på
@INTERNET Wikipedia Ultimate tensile strength 2010-10-15
http://en.wikipedia.org/wiki/Ultimate_tensile_strength
RELATIVT OMFATTADE MATERIALDATA finns på
webben i svenska versioner; Sök på typ Brottgräns, Aluminium, och flera olika
svenska källverk ger besked.
Generellt och grovt ligger brottgränserna (Rm)
i storleksordningen 200-400 MPa för Koppar-Aluminium-Järn-Nickel; Ståltyperna
(Kolstål) ligger på ca 1-1,5 GPa.
Wikipediatabellen (ovan) ger i sammandrag
brottgränsen i MPa för materialen nedan (grovt alla metaller runt 40-400 MPa)
Aluminium 40-50 brottgränsen [Rm] i MPa = T6 N/M², gäller
motsv. glödgat [ohärdat] tillstånd
Bly 12
Guld 100
Järn 350
Koppar 210
Nickel 140-195
Silver 170
Tantal 200
Tenn 15-200
Titan 240-370
Wolfram 550-620
Zink 110-200
Människohår 380
EXEMPEL:
Brottgränsen
(Rm) [eng. tensile strength] för segjärn är enligt
MATERIALLÄRA (Karleboserien 5 1980 s205 Tabell 7.2 Segjärn) lägst 400 N/mM², analogt 400 N/(0,001M)² =
4 T8 N/M² = 4 T8 Pa = 0,4 GPa. TNED-formen
ger för 26Fe56 värdet vid d=0 enligt 1,6645 T8 N/M² ~ 0,17 GPa.
[IDEALT: Med tillräckligt näravstånd
»kopplar» atomerna inbördes kemiskt, en viss energi frigörs, och en låsning
inträffar typ »kardborrefunktion» som parkerar materialet på dess naturliga
brotthållfasthet].
Analogin, som visar att det i så fall
skulle behövas en (liten) bit till, utsäger: Pressar man ihop två materialytor
mekaniskt till deras motsvarande atomära medelavstånd blir resultatet INTE en
motsvarande material sammansmältning. För att nå dit måste ytterligare en
(liten) bit tillfogas (ett tröskelvärde) som här i exakt ekvivalenta termer
skulle bli d=–0,082 nM (4,064 T8 Pa) för att få attraktionstrycket runt
4 T8 N/M². Dvs., ytterligare en intryckning från atommedelavståndet
2,28 Å (0,228 nM) med ca 27% för att få fram det atommateriallåsande »klicket».
Det är dock orealistiskt att tänka sig
något EXAKT klick för EXAKTA materiella brottgränsvärdet. En mer realistisk
funktion kräver (mycket) mer extra intryck för att få låsning på normala
materialvärdet:
Se vidare webbdata från olika laboratorier
i Kallfogningsgränser.
Parbildning i MAC
2010IX17
Parbildning i MAC
Se
även exempel på par-|positron-bildning via fotografier från bubbelkammare i Elektronens bubbelkammarspår
e– → | Z | ~~~ γ → ± X
.......................... parbildningsmekanismens
typform genom elektronstrålning
elektronstråle material partikelpar
eller laser
eller kombination
Bethe-Heitler [1934] är
de främst nämnda pionjärer som associeras med den första användbara matematiska
fysiken för experimentellt påvisande av parbildning [H2] [H3] [H4]. Parbildningsmekanismen
har efter pionjärerna fått den generaliserande benämningen Bethe-Heitler mekanism. Processen som
verkställer transformationen benämns Bethe-Heitler
process.
(Z
betecknar atomnummer — här också generellt något grundämnesmaterial, det
centrala konverterings- eller bestrålningsmaterialet, se citat).
En
(översvallande) stor mängd (PDF-) dokument finns på webben (Sep2010) som
·
INTE klargör Z-delen i
ekvationerna;
·
INTE beskriver eller
förklarar vad ’Bethe-Heitler process’ är — men använder terminologin frekvent.
Den
allmänna praktiken bland ämnesförfattarna är istället [Se exempel i Burke et al., 1977 s1626sp1ö, H5 och H6] att favorisera den rena ideala MAC-teorins s.k. Breit-Wheeler
process och använda denna i
samband med experimentella beskrivningar av Bethe-Heitler
processen.
Ofta
förekommande skrivsätt för Breit-Wheeler processen
är
ω
+ ω0 →
e+ + e–
2γ
→ e+ + e–
I relaterad fysik (TNED) existerar ingen praktisk motsvarighet för
den modern akademins ideala massa-från-ljus transformation —
Breit-Wheeler-uttrycken är, och förblir, de rent kvantitativa aspekterna på
energitransformationer vars kvalitativa former bara kan realiseras med hjälp av redan
befintlig materia:
Som
redan tidigare påpekats enligt energilagen
i relaterad fysik, KAN massa
förintas därför att den INTE kan skapas; Energi är i relaterad fysik
kvantitativt utbytbar mot massa, inte kvalitativt. Ljus kan inte skapa
laddning, massa och spinn, bara härma och ersätta dess kvantitativa aspekt. Se
även i citat.
Ämnesförfattarna
(emellertid) verkar t.o.m. SÅ uppslukade av (det ännu Sep2010 hägrande)
Breit-Wheeler idealet att man helt tycks bortse ifrån den centrala
materialaspekten (Z) och bara ser denna som en ’nödvändig stoppform’ — som om
den rena ideala teorin redan vore bekräftad. Explicit citatkälla som intygar att så
INTE är fallet finns i Ruffini et al.,
2009 s629m. Genom (den stora)
bredden på ämnesförfattare som tycks ha glömt av den delen, bildas (lätt) en
allmän uppfattning att materia från ljus REDAN skulle vara en
allmänt bekräftad experimentell observation — samt att (därmed) QED i MAC skulle vara väl
befäst.
Notera alltså den etablerade uppfattningen om parbildning —
också med föreställningen om »vakuumets polarisation»
Man bortser [H5] [H6] ifrån den nödvändiga materialdelen i centrum (Z), och
(tydligen, utan att explicit skriva ut det) anser inte att den har någon
koppling till typ positronförekomsterna, utan menar att dessa SKAPAS ur
ljusenergin (hf) som resultat av typ »våginterferensen omkring Z-materalet».
Man får verkligen LETA i experimentbeskrivningen [McDonald 1977,
Burke et al., 1998, m.fl.] för
att hitta Z-representationen (leta på ”wire” och ”foil”). Det som framhävs är
(således) ”the first
laboratory evidence for inelastic light-by-light scattering involving only real photons”.
Först
när man kan visa att positroner (och elektroner) strömmar från en mötespunkt
mellan två (eller flera) laserstrålar i vakuum — den rena förmodade Breit-Wheeler
processen, inga mellanliggande
material — kan ovanstående säkert
intygas.
Med dagens (2010) laserteknik räcker ännu
inte intensiteten för att nå det teoretiska målet i praktiken.
Se Breit-Wheeler-målet för ett möjligt scenario som kan realisera det hägrande
målet.
Citatet
nedan intygar att målet inte är nått.
”1. Introduction
The vacuum pair creation effect by a classical electric field has been predicted in QED
a long time ago [1, 2]. A complete theoretical description of this effect has
been obtained [3]-[6], but there
is still no experimental proof. The main
obstacle is the high
value of the critical electric field strength
for the pair creation, Ecr = 1.3×1016 V/cm
for electron-positron case.”, s121n,
INSTITUTE
OF PHYSICS PUBLISHING —
Observable
manifestation of an electron-positron plasma created by the field of an optical
laser — Blaschke et al., 2006
http://iopscience.iop.org/1742-6596/35/1/010/pdf/1742-6596_35_1_010.pdf
Massa-ljus-massa-omvandlingar
i MAC
2010IX15
Massa-ljus-massa-omvandlingar i MAC
PARBILDNING
parannihilation
EN
STOR SVÅRIGHET — generellt i modern akademi — vid det webbaserade materialet
(Sep2010) om SKAPELSE AV MASSA UR ENERGI vittnar alldeles tydligt om Problemet
att skilja mellan massa (KAN vägas på brevvåg) och ljus (kan INTE vägas på
brevvåg [se även i Värmegrunderna]), samt att göra den väsensskillnaden tydlig för
läsaren. Nämligen, främst, enligt följande (som det tar ett tag att hitta):
”The Breit–Wheeler process, on the contrary, is still today
waiting a direct observational verification.”, s629m,
SKAPELSE
AV MASSA UR ENERGI — i modern akademi (här ofta MAC) — beskrivs renodlat av tradition i MAC med typbegreppet
s.k. Breit-Wheeler-process (eng.
Breit-Wheeler process). Den skrivs (typiskt)
ω1+ω2 → e+e–
alt.,
2γ → e+e–
Och —
vilket var det hjärtligt centrala: Det är ypperligt LÄTT att få den saken helt
om bakfoten med hjälp av den moderna akademins speciellt entusiastiska författarskara i ämnet. Nämligen i den FÖREGIVNA
uppfattningen att massa (positroner, e+) framträder ur det här:
elektronstrålar + laserstrålar.
Det
är alldeles riktigt att det är DIT man strävar — men som citatet ovan
understryker (vilket man finner först efter visst letande): man är inte
(riktigt) där än.
—
MEN: Vad är det då, om inte ’elektronstrålar + laserstrålar’?
—
Elektronstrålar + laserstrålar + ALUMINIUMFOLIE (eller wire: tråd eller folie). Vidare i citat
nedan.
— Men det är verkligen ingen lätt sak (för
en utomstående lekman) att HITTA passagerna — med nuvarande selektering i
författningarna. Man får leta — men man skulle inte behöva göra det med ytterst
enkla grepp från författarna (Det verkar ibland som att artikelförfattarna
anstränger sig för att Utelämna så många potentiella Nya läsare som möjligt,
och vilken författarskara verkar vilja avgränsa ämnet till en så snäv
population som möjligt och som redan underförstått är bekant med facktermerna —
trots att man med ytterst enkla grepp kan bredda repertoaren betydligt).
— Aluminiumfolie, metalltråd ... ?
— OM varje atomkärna enligt TNED MINST består av en
sammansätt ±e-väv av A909e-par med summa noll impulsmoment
J[0K]+3J[1K]=0, A masstalet, är det
inte svårt att förstå att det är något mysko med »positronbildning från laser»
då man i själva verket måste ha ett föremål, en metalltråd eller en
metallfolie, i vägen för laserstrålen: »positronbildning FRÅN ATOMKÄRNOR VIA
laser».
DET
MAN FÖRST (Sep2010) HITTAR på ämnet ’positrons from light’, min referens:
;
”The positrons are interpreted as arising
from a two-step process in which laser photons are backscattered to GeV energies by the electron beam followed by a collision between the high-energy photon and several laser photons to produce an electron-positron pair.”, första sidan, onumrerade sidor,
”These
results are the first
laboratory evidence for inelastic light-by-light scattering involving only real photons.”,
POSITRON PRODUCTION BY LASER LIGHT — Kirk T. McDonald, datum
saknas (1997)
http://www.hep.princeton.edu/~mcdonald/e144/ssitalk.pdf
Sidnumrering
saknas i det långa PDF-dokumentet, källan omnämner inte Bethe-Heitler
”A signal of 106 ± 14 positrons above background has been observed in collisions of a
low-emittance 46.6 GeV electron beam with terawatt pulses from a Nd:glass laser
at 527 nm wavelength in an experiment at the Final Focus Test Beam at SLAC.”,
”The positrons are interpreted as arising
from a twostep process in which laser photons are backscattered to GeV energies by the electron beam followed by a collision between the high-energy photon and several laser photons to produce an electron-positron
pair.”,
”These
results are the first
laboratory evidence for inelastic light-by-light scattering involving only real
photons.”, s1626mö.
”…
these results are the
first observation of inelastic photon-photon scattering with real photons.”, s1629sp2mö.
POSITRON PRODUCTION IN MULTIPHOTON LIGHT-BY-LIGHT SCATTERING — Burke et
al., 1997
http://www.physics.princeton.edu/~mcdonald/examples/accel/burke_prl_79_1626_97.pdf
”this
is the first observation
of inelastic light-by-light scattering
involving only real photons”
STUDIES OF NONLINEAR QED IN HIGH ENERGY ELECTRON–LASER COLLISIONS
— Th. Kotseroglou, 1998
http://www.maik.ru/full/lasphys/98/1/lasphys1_98p142full.pdf
Flera
av samma typ (men med olika omfattning) finns med utspridda senare datum och
som avhandlar samma uppsats men med (framhävda) olika författargrupper.
Burke et al., 1997 ovan, som är relativt kort och till synes välskriven och
välrelaterad, omnämner på flera ställer en (för lekmannen) mysko ”wire” enligt
”The response of PCAL to positrons originating at IP1 was studied by inserting a wire
into the electron beam at IP1 to produce e+e– pairs by Bethe-Heitler conversion of bremsstrahlung photons.”,
sp2s1627m.
’To
produce’?
Lekmannen
kliar sig förtvivlat i huvudet och undrar vad i all sin dar det är för något avancerat
han har missat?
Fraserna
Burke-gruppen använder är
”wire
into the electron beam at IP1 to produce e+e– pairs”,
”the
density of clusters
produced by the wire”,
”Cluster
densities from positrons
produced by a wire”.
Mystiken
tätnar [Fast vi som redan känner till TNED vet vart det lutar].
En
mera utförlig beskrivning i samma uppsats finns tydligen i PDF-dokumentet
(samma som Burke fast mycket längre, mera utförligt)
PHYSICAL REVIEW D, VOLUME 60, 092004 — Bamber et al., 1999
Studies
of nonlinear QED in collisions of 46.6 GeV electrons with intense laser pulses
http://viper.princeton.edu/~mcdonald/e144prd/prd_60_092004_99.pdf
med
’wire’ ersatt av ’foil’ och typcitaten
”By
placing a thin foil in the beamline at 0° from the interaction region, it was possible to convert a fraction
of the forward photons, and to measure the converted electrons (or positrons) in a magnetic
spectrometer, as discussed in Sec. III D.”, s8sp2m,
;
”For
a small portion of the running, some of the scattered photons were converted to electron-positron
pairs in a thin foil, and those charged
particles were analyzed in a spectrometer containing charged-coupled-device
(CCD) pixel detectors and SCAL calorimeters downstream of a 5D36 magnet.”,
s11sp2mö,
;
”This
was confirmed in the case of the PCAL in calibration runs in which a foil was placed at IP1 to generate a
spectrum of Bethe-Heitler positrons from the
conversion of bremsstrahlung photons.”, s15sp2mn
;
”Some
data were collected with the forward-photon monitor removed from the 0°
beamline, and a thin foil
inserted to convert a small fraction of the forward photons to electronpositron
pairs. These were deflected by 10–30 mrad
into the CCD spectrometer by a 5D36 magnet, as shown in Fig. 11.”, s23sp1m;
med
’foil’-specifikationen
”At
high laser intensities, there were typically Nγ ~ 107 photons
scattered into the forward direction, with only ~ 1% of these at momenta beyond
the n=1 Compton edge.”, s28sp2n,
”A 50-µm-thick aluminum foil was used as a converter (5.6×10–4
r.l.), so that ~ 5000 pairs entered the pair spectrometer (Fig. 22) in each
laser pulse.”,
och
den slutliga upplysande figuren
FIG.
23 s17sp2ö, Bamber et al., 1999
’Cerenkov
Periskop’.
’Aluminium-konverterare’.
Med
andra ord:
Det går (ännu 2010) inte utan Aluminiumfolien
— Fast många vill gärna tro det.
Men
den avgörande Aluminiumfolien omnämns knappast i de övriga (trängre)
författningarna:
— Burke omnämner bara ”wire” 3ggr, ingen ”foil”, ger ingen
upplysande ’Cerenkov Periskop’-figur.
— McDonald omnämner inte ”wire” men ”foil” en gång, samt ger [i
Figure 6(b)] ’Cerenkov Periskop’-figuren.
— Kotseroglou omnämner ”wire” 2ggr, ingen ”foil”, ger ingen upplysande
’Cerenkov Periskop’-figur.
Ingen av författarna säger det (här veterligt) klart och rent ut:
det går inte utan Aluminiumfolien. Vi ser det bara (indirekt) genom
citatgruppen i Bamber et
al., 1999
— eller nära direkt i det blocket genom
”some of the scattered photons were converted to electron-positron pairs in a thin foil”.
Det
är snudd på rekord.
(Dessa författare vill inte ha någon
publik, helt klart).
Positronerna framträder i
Aluminiumfoliens inre turbulenta elektromagnetiska atomfysik — INTE genom någon
allmän offentlig utställning på Sveavägen 7-4 under flera minuter där man
tydligt SER elektronstråle i rymden + laserstråle i rymden som träffas och från
vilken mötespunkt det strömmar positroner, och som (den sensationsbenägna)
lekmannen väldigt gärna kan vilja föreställa sig saken.
Den
enda (mera refererande, nya) McDonald-Kotseroglou-Burke oberoende
författarkällan jag hittat — och som omnämner den (med flera) — är Ruffini et al., 2009
ELECTRON-POSITRON PAIRS IN PHYSICS AND ASTROPHYSICS: FROM HEAVY NUCLEI
TO BLACK HOLES
— Ruffini
et al., 2009
http://www.icranet.org/4th_ICRANet_Scientific_Committee/Volume2-Scientific_Report/08Xue_b.pdf
s621-s921 (300s), omfattande, utförligt refererad avhandling med
en stor mängd (över 500) referenser
Ruffini
refererar i sin referens (39) till Burke et al., 1997,
”The
phenomenon of e+e– pair production in
multi-photon light-by-light scattering has been reported in (38; 39;
254; 211) on the experiment SLAC-E-144 (277; 63).”, s737m,
;
”This
shows that the pair
production of Breit–Wheeler type by the
anti-adiabatic, perturbative multi-photon production mechanism, described by
Eqs. (5.10.9), (5.10.11) or (7.2.9), (7.2.12) for small η <<
1, has been
experimentally confirmed.”, s738mn;
»Breit–Wheeler
process, 2γ → e+e–», s621mö,
Här är det alltså tydligt att
författarna är så uppslukade av ämnets sensationella natur, att man gör ett
felaktig, väsentligt, påstående. BW-typen, som (ovan) samma författare intygar
i föregående citat fortfarande tarvar ”a direct
observational verification” är här
plötsligt bekräftat, som ovan, ”has been experimentally confirmed”. Framställningssättet kan uppenbarligen inte bli mer
kaotiskt.
Bethe-Heitler mekanismen — parbildningens experimentalform
e– → | Z | ~~~ γ → ± X
.......................... parbildningsmekanismens
typform genom elektronstrålning
elektronstråle material partikelpar
eller laser
eller kombination
Bethe-Heitler [1934] är pionjärerna som
associeras med den första användbara matematiska fysiken för experimentellt
påvisande av parbildning. Parbildningsmekanismen har efter pionjärerna fått den
generaliserande benämningen Bethe-Heitler mekanism. Processen som
verkställer transformationen brukar benämnas Bethe-Heitler
process.
Ruffini verkar (bland många upphittade) vara den enda avvikande
källan av de många, många som väl använder begreppet och termen ’Bethe-Heitler
process’ men som aldrig beskriver den termen i klartext (Wikipedia har
den t.ex. ännu inte 15Sep2010, heller inte Breit-Wheeler process);
”Currently
available technologies allow for intensities of the order of 1020
W/cm2 leading to abundant positron production essentially through the Bethe-Heitler process (3.3.1) with number densities of the order of 1016 cm–3
(276).”, s737mö,
”
γ
+ Z → Z + e+ + e–. (3.3.1)
”,
s649mö,
;
(Z
betecknar atomnummer — här också generellt något grundämnesmaterial, det centrala
konverterings- eller bestrålningsmaterialet, citatet ovan).
MED
ANDRA ORD: så svårt det alls kan bli för en lekman att få fatt på (det i
grunden helt enkla) sakinnehållet;
Notera
således skillnaden i SAK:
Breit–Wheeler process 2γ
→ e+e– .............................. den
rena ideala MAC-teorins ljus-till-massa
konversion [BW-processen]
Bethe–Heitler process 2γ
+ Z → Z + e+e– .............. den
(ännu enastående) experimentellt
praktiska BW-maken [BH-processen]
Vilken är skillnaden?
Z-typen
tillhör TNED. Den
klargör att positronbildning INTE kan komma ifråga på något ANNAT sätt än att
en POSITRONGRUNDAD MASSKÄLLA finns närvarande: atomkärnan,
centralmassivet
på 1818e = ±909A par elektroner-positroner, A masstalet.
Den renodlade BW-typen finns inte i relaterad fysik (TNED) — inte nu, inte någonsin.
Som redan tidigare antytts enligt energilagen
i relaterad fysik därför att
massa kan förintas därför att den inte kan skapas; Energi är i relaterad
fysik kvantitativt utbytbar mot massa, inte kvalitativt. Ljus kan inte skapa
laddning, massa och spinn, ljus kan inte skapa materia, byggnader, hus, atomer,
bara härma och ersätta de materiella tingens kvantitativa aspekt [BIO].
Energiutbyte. Inte masskapelse.
FÖRMODLIGEN
har man — numera — i moderna kvarter ’hunnit bli så förtrogen’ med det helt
kvantiserade begreppet E=mc² [se även Einsteins härledning] och dess enorma landvinningar inom experimentalfysiken
att man inte ser annat än ’rena BW-processer’ bakom alla och de enda praktiska
BH-processer som (ännu Sep2010) finns på experimentalfysikens bord. Man tror —
nog, helt bergfast — att det ’bara är en fråga om tid’ innan man hunnit
utveckla tillräckligt kraftfulla laserbord som kan betjäna en mera regelrätt
ljuslaser-vakuum-demonstration. Vidare nedan.
Det avgörande experimentet kan komma redan inom ett decennium
— om
utvecklingen på laserteknikens område håller nuvarande takt
Enligt
uppgift från 2008
MICHIGAN LASER BEAM BELIEVED TO
SET RECORD FOR INTENSITY — Feb2008
http://www.physorg.com/news122298608.html

uppvisar
en av världens nu mest högintensiva lasrar ett intensitetsvärde (I=P/A, W/M²) på ca 2 T26 W/M². En (konventionell) lasers
elektriska fältstyrka kan beräknas [Se exv. Ruffini et al., 2009 s731ö] ur
Ξ
= √ R0(P/A) med R0 ~ 377 Ω ................................. V/M, den konventionella laserns elektriska
fältstyrka ur intensiteten
Wikipedia
har på sin artikel Laser på avdelning Recent innovations
(2010-09-15) ett diagram som visar den tekniska laserutvecklingen perioden
1960-2010 — med en från 1985 i stort sett linjär stegring 1985-2000 från skalvärdet
T15 till
T23. Det gör grovt sett en tiopotens varje 1,875 år (Skalvärdet anges i
figuren till /cM², men måste uppenbarligen vara /M² för att uppgiften ovan från
Michigan ska stämma, annars blir potenserna 4ggr för stora).
Nu är MAC-gränsvärdet för ’vakuumets
spontana elektron-positron-uppkomst’ lika med
Ξ = m2c3/eħ
=
1,32319 T18 V/M
~
1,3 T18 V/M
Se även Ruffini et al., 2009
s621
”The vacuum
polarization process
in strong electromagnetic field, pioneered by Sauter, Heisenberg, Euler and
Schwinger, introduced the concept of critical electric field Ec = me2c3/(eħ).
It
has been searched without success for more than forty years by heavy-ion collisions in many
of the leading particle accelerators worldwide.”, s621m.
;
FÖRKLARING:
Man använder sambandet för elektriska
fältstyrkan
Ξ = U/d = (E/Q)/d
med d från de Broglies
vågekvation (se även MIC)
d = h/mc
som ger
Ξ = E/(Qd) = mc2mc/eh
= m2c3/eh
Genom d mera renodlat som en
omkrets d=2πr
används engelskans ’h-bar’-tecknet ħ=h/2π som ger
Ξ = m2c3/eħ
=
1,32319 T18 V/M
~
1,3 T18 V/M
med e för elektronladdningen (1,602 t19 C), m för elektronmassan (0,000548598u, u=1,66033 t27 KG), h för Plancks konstant (6,626 t34 JS) och c för toppdivergensen (2,99792458 T8 M/S).
Dvs., man använder i MAC föreställningen om ’elektronen’ (Q) och ’elektronens radie’ (2πr) som ett ekvivalent
mått på ’elektronperiferins elektriska fältstyrka’.
Den
motsvarande konventionella laserintensiteten för ändamålet kan då beräknas
enligt
Icrit = (Ξcrit)2/R0
= (1,3
T18 V/M)2/(377 V/A)
=
4,48275 T33 [W/M² = V²A/VM² = VA/M²
]
~ 4,5 T33 W/M²
RESULTAT:
Med
runt räknat 33–26=7 tiopotenser kvar att avverka i teknisk laserutveckling,
återstår med
1,875
år per tiopotens
tiden
runt och grovt
t =
(7)(1,875)
= 13,125 år
innan
experimentet står på bordet: preliminärt år 2023 — om den tekniska utvecklingen
på området håller samma takt (Jag vågar tippa inom ett decennium [kanske före
2020], därför att potentialen verkar vara särskilt stor på just
forskningsområdet för laser — det är många, många forskare som verkligen vill
SE resultatet).
Tills dess är helt säkert BH som
gäller.
Historia
HISTORIA
PARBILDNING parannihilation
”The annihilation of electron–positron pair into two photons, and its inverse process – the
production of electron–positron pair by the collision of two photons were first studied in the framework of quantum mechanics by P.A.M. Dirac and by G. Breit and
J.A. Wheeler in the 1930s (1; 2).”, s629ö,
”The Dirac
process, e+e– → 2γ, has been by far the most
successful.”, s621mö,
”One
development inquired electron–positron
pair creation by the interaction of photons
with nuclei following the reaction:
γ
+ Z → Z + e+ + e–, (3.3.1)
major
contributors were Oppenheimer and Plesset (94), Heitler (95), Bethe-Heitler (96), Sauter (97) and Racah (98).”, s649mö,
;
”In
parallel progress on the reaction
e– + Z → e–
+ Z + γ, (3.3.7)
was
made by Sommerfeld (103), Heitler (95) and later by Bethe and Heitler (96).”, s650m,
”Bethe and Heitler13 (1934) treated both the bremsstrahlung and
the pair production relativistically using
the Born approximation, in which the screening of the nuclear coulomb field was properly taken into account. Wheeler and Lamb14
(1939, 1956) treated the same phenomena in the field of atomic electrons.”,
”Experimentally, the productions
in the nuclear coulomb field and the electron field always occur together, hence two effects must be combined in order to make
comparison with experiments.”,
”When
the atomic number Z is large, the correction to the one photon exchange
mechanism must be included and this was done by Bethe and Maximonl5
(1954), Davies, Bethe and Maximo16 (1954), and Olsen17
(1955). It should be noted that in Bethe and Maximon, l5 it was
erroneously stated that the Coulomb correction affects only the pair production
but not the bremsstrahlung. This error was corrected by Olsen l7 (1955).”,
s5m|s816sp2m,
”Bethe and Heitler13 (1934)
treated a special case in which the target particle is an infinitely heavy pointlike and
spinless nucleus whose coulomb field is
screened by atomic electrons. They did not include the atomic excitation of the
target which was later considered by Wheeler and Lamb (1939).l4”,
”While
these treatments by Bethe and Heitler13 combined with the work of
Wheeler and Lamb14 adequately describe the pair production of electrons at high energies
and small angles, they are not adequate to
describe the pair production of particles with mass of muons or heavier,
because the effects of nuclear form factors and the recoil of the target system
must be included when heavy particles are produced.”,
”Even
in the electron pair production the nuclear form factors and the recoil must be
taken into account if the production angle is large. In fact when the
transverse momentum of the particle produced is much larger than the mass, the
cross section is nearly independent of the mass of the particle produced.”,
”Drell
and Walecka (1964)38 generalized the result of Bethe and Heitler to deal with a
target of arbitrary mass, spin and form factors and arbitrary final states.”,
s9ö|s817sp2mn,
”Observation
of positrons created in the collision of Compton backscattered photons with a laser beam in the multiphoton Breit-Wheeler reaction,
ω
+ nω0 → e+e–. (17)
”, sidnumrering
saknas,
;
”Pair creation via the interaction of
two light quanta,
ω
+ ω0 → e+e–. (26)
was
first considered in 1934 by Breit and Wheeler,36 who remarked that
although the cross section is of the same order of magnitude as the Compton-scattering
cross section “it is hopeless to try to observe pair formation in laboratory
experiments with two beams of γ-rays meeting each other on account of the
insufficiently large densities of quanta”. Indeed, this process has not been
directly observed prior to the present experiment. It is, however, believed to
be responsible for the fall-off of the spectrum of astrophysical γ-rays at
very high energies.37”, sidnumrering saknas,
”The
first process is nonlinear
Compton scattering, in which an electron
absorbs multiple photons from the laser field, but radiates only a single
photon:
e
+ nω → e’ + γ, (1)
where
ω represents a photon from the strong electromagnetic wave, n
indicates the number of such photons absorbed, and γ represents a
high-energy photon. This process has a classical limit, Thomson scattering, and
the case of n>1 corresponds
to
higher-multipole radiation.
In the second process, one or more of the laser photons is Compton scattered
from the electron beam via process (1),
producing
a high-energy photon. As this
photon propagates through the laser field,
it can interact to
produce an electronpositron
pair:
γ
+ nω → e+ + e–, (2)
This is referred to as Breit-Wheeler pair production, and can be regarded as the materialization of a
vacuum-polarization
loop in a strong field.
Our first observations
of processes (1) and (2) have
been reported in [1] and [2],
respectively.”, s1sp1n,
”Due to the interaction of physics and astrophysics we are witnessing in
these years a splendid synthesis of theoretical, experimental and observational results
originating from three fundamental physical processes. They were originally
proposed by Dirac, by Breit and Wheeler and by Sauter, Heisenberg, Euler and
Schwinger. For almost seventy years they have all three been followed by a
continued effort of experimental verification on Earth-based experiments. The Dirac
process, e+e– → 2γ, has been by far the most
successful. It has
obtained extremely accurate experimental verification and has led as well to an
enormous number of new physics in possibly one of the most fruitful experimental
avenues by introduction of storage rings in Frascati and followed by the
largest accelerators worldwide: DESY, SLAC etc. The Breit–Wheeler process, 2γ
→ e+e–, although conceptually simple, being the inverse
process of the Dirac one, has been by far one of the most difficult to be verified
experimentally. Only recently, through the technology based on free electron X-ray laser and
its numerous applications in Earth-based experiments, some first
indications of its
possible verification have been reached.
”, s621mö,
ELECTRON-POSITRON PAIRS IN PHYSICS AND ASTROPHYSICS: FROM HEAVY
NUCLEI TO BLACK HOLES
— Ruffini
et al., 2009
http://www.icranet.org/4th_ICRANet_Scientific_Committee/Volume2-Scientific_Report/08Xue_b.pdf
s621-s921 (300s)
”The Breit–Wheeler process, on the contrary, is still today
waiting a direct observational verification.”, s629m,
Ytterligare bekräftelser på TNED
POSITRONER
FRÅN GULDATOMER VIA LASER 2009
Ytterligare bekräftelser på TNED
Genom att de kortpulserande (1pS) laserpulserna repeterat
skjuter 1MeV-pulser mot atomkärnor, kan det för varje sådan puls avges ett
elektron-positronpar i utbyte — och så långt lagret räcker: Enligt TNED, per atomkärna lika med ±909A,
för Guld (A=197) lika med max 179073 par ±e [Se utförligt från 1818e-massivet]
[~1,14606 T34 (e+)/M³ = 1,14606 T28 (e+)/cM³].
Med andra ord: Bekräftelser på TNED.
Försöken i
—————————————————————————————————————
Physical Review Focus — LASERS PROVIDE ANTIMATTER BONANZA, 2009
http://focus.aps.org/story/v23/st8
—————————————————————————————————————
rapporterade 1 T16 (e+)/cM³.
Föreställningen
i MAC att
’massa skapas ur masslös ljusenergi’ [‡6] blir i ljuset av elektronmassans komponenter (tau-ringarna), en alldeles uppenbarligen helt säkert
djupt rotad feluppfattning [Se Strukturargument
för elektronen] — Den
förvärras betydligt av att man inte heller (ännu Sep2010) tycks räkna med
möjligheten att atomkärnan består av en ekvivalent sammansätt väv av ±e
(909A elektron-positron-par, se särskilt från CENTRALMASSIVET
i TNED);
laserbestrålning på guldatomkärnor ’skapar’ ±e-skurar,
Physical Review Focus — LASERS PROVIDE ANTIMATTER BONANZA, 2009
http://focus.aps.org/story/v23/st8

±e-par från guldatomkärnor — beskrivning
Med
den nya högpresterande lasertekniken, med korta högenergetiska intermittenta pulser
(på minst motsvarande 1 MeV per) som riktas mot typ guldfolier,
”A
research team used lasers to produce more positrons (anti-electrons) inside a
solid than any previous experiment, according to the researchers involved. In
the 13 March Physical Review Letters, the team describes firing short pulses from an intense laser onto thin gold targets and creating a high-density positron
source that could be used to investigate
exotic phenomena near black holes or supernovae.”,
Physical Review Focus — LASERS PROVIDE ANTIMATTER BONANZA, 2009
http://focus.aps.org/story/v23/st8
visar
sig rent experimentellt och i full enlighet med TNED en skur av elektron-positronpar som frigörs ur de tunga
atomkärnornas ±909A elektron-positronbank.
Max antal ±e-par som kan frigöras ur
en guldatom är enligt TNED
909(197)=179073;
±e-tätheten per cM³ är (med kubiska
medelavståndet mellan atomerna som ca 2,5 Ångström = 2,5 t10 M) lika med
1,14606
T28 (±e)/cM³
med motsvarande halva
positrontätheten
5,73030
T27 (e+)/cM³
I de
nyare laserexperimenten har man hittills (2009) uppnått
1 T16
(e+)/cM³
Det
finns — således — ännu mycket kvar att hämta.
”Hui
Chen and Scott Wilks of the Lawrence Livermore National Laboratory in
California and their colleagues now report that they have generated copious
amounts of positrons with intermediate energies--in the range of a million
electron-volts.”,
”They
fired picosecond pulses with intensities of around 1020 watts per
square centimeter from the Titan laser at Livermore's Jupiter laser facility
onto millimeter-thick gold targets. Positrons were produced via the "Bethe-Heitler"
process, in which part of each laser pulse
creates a plasma on the surface of the target, and the remaining part of
the pulse then blasts
electrons from the plasma into the solid.
Next, the electrons are
slowed down by gold nuclei, an interaction that generates
gamma-ray photons. The gamma rays then interact with more gold nuclei and transform into electron-positron pairs.”,
Physical Review Focus — LASERS PROVIDE ANTIMATTER BONANZA, 2009
http://focus.aps.org/story/v23/st8
Medan
(således) TNED
(tydligen) fortsätter att bekräftas främst rent kvalitativt per experimentalfysikens
fortsatta tekniska utveckling, avancerar tydligen MAC vidare inåt i väven
av mera avancerade föreställningar.
Förr
eller senare kommer urladdningen.
Strukturargument för elektronen
Tillägg
till artikeln Ytterligare
bekräftelser på TNED —
Angående QED1 i MAC:
—————————————————————————————————
Genom
att elektronen-positronen uppvisar STRUKTUR [gen. materialens olika
termoelektrooptiska egenskaper — resonansverkan, olika mönster],
—
består av en viss mängd strömringar baserade på massa, laddning och spinn och
som ansluter till massprincipen i TNED med obegränsat underliggande underfraktaler för att
kunna betjäna primära
massförstöraren (E=mc²)
vid parannihilation,
blir
varje reguljär SKAPELSE av elektron-positronmassa utesluten ur fysiken enbart
av strukturens skäl.
ENERGILAGEN i relaterad fysik visar redan i sig, mera
elementärt, att massa kan förintas därför att den inte kan skapas
— och blir därför enbart i sig det enda kriterium som behövs.
Men det är — ändå — inget argument i MAC eftersom man där
redan har kommit överens om (sedan 1927) att det är tillåtet att göra våld på energins bevarande
i QED.
Tills atomkärnan uppdagas som en sammansatt
väv av ekvivalenta 909A elektron-positronpar [proportionaliteten
massa-laddning i NEUTRONEN via PASTOM i
TNED ger
m[e]/m[n]=1836,624e
med TNED-uppdelningen i 1818e+18e+2,624e med
centralmassivet 1818e=±909e som bevaras i varje atomkärna per
nukleonmassenhet, totalt minst A909e-par för varje nuklid med
A=masstalet] kan man därför i MAC fortsätta att behålla sin uppfattning att massa (±e) skapas
ur masslös ljusenergi (med hjälp av laser) — som dock (ännu Sep2010) måste
träffa redan befintlig ±e-materia, se BW-BH-processen.
Induktansen klargör
Men
det finns ytterligare ett argument i relaterad fysik mot MAC. Nämligen induktansen (L). Närmare bestämd den elementära rymdinduktansen:
—
Även OM man gör överenskommelser som går ut på att ’det finns negativ
rymdinduktans’ måste man konsekvent uppfinna ’negativ rymd’; I relaterad fysik,
i universums praktiska fysik, utgår induktansbegreppet ifrån
[Se Uppkomsten
av induktion och magnetism enligt relaterad fysik]
divergensen
(c) med ljusets absolutacceleration (a=c/dT) och Ändringslagarna
(varje
tillståndsändrande kraft motsvaras av en lika stor tillståndsbevarande kraft)
med
uppkomsten av ett motsvarande rymdmostånd (R) med förankring i härledningen
från gravitationen
(GRIP), se explicit GcQ-teoremet, och som uppställer begreppet rymdkompakthet (konv. magnetiska konstanten)
µ =
R/c
................................ rymdkompaktheten,
VS/AM
och
som leder till rymdinduktansen enligt
RdT
= µds ..................... rymdkompakthetens
differentiella längdberoende (strömriktningen), VS/AM · M = VS/A
Det
finns, relaterad fysik, bara en — 1 — rymd där fysikens fenomen iakttas, observeras
och studeras — inte flera. Liksom negativ temperatur, negativ energi eller
andra negationer av absoluta storheter i relaterad fysik saknar praktisk
betydelse, kan inte heller negativ induktans förekomma i naturbeskrivningen
(gäller inte i MAC, jämför QED1).
Den — här, antydda — aspekten på ±R i
sammanhanget gäller nämligen via PARANNIHILATION
och energins bevarande enligt
E = LQ2/t2 ................. se Kommutativa energiekvivalenten i Massvärmet
med
Q2 = (m/R)(A/dT) ....... elektriska laddningens kvadrat, ingår inte i MAC
Då m|Q
försvinner [Parannihilation, (m→γ)] tvingas induktansen (L) öka
med given utgångsenergi (E): OM m i realiteten aldrig försvinner, utan
fortsätter att vara den spektakulära massa som MAC kräver, skulle heller ingen observerbar induktiv effekt
[gammastrålningen (γ) i (m→γ)] alls kunna observeras då
±e förintas, och därmed inget påvisade alls av någon som helst koppling
till en primär
massförstörelse [E=(m→γ)c²]:
Blotta energiöverföringen i (m→γ) bygger på att L ökar på
bekostnad av att Q avtar.
Det faktum ATT en experimentellt
observerbar diametral gammapuls ALLS existerar från parannihilation är
(således) det enda kriterium som alls krävs ENLIGT RELATERAD
FYSIK för att säkert fastställa
att sambandet E=(m→γ)c² verkligen är kvalitativt
irreversibelt men kvantitativt kommutativt. Dvs., energi kan UTBYTAS ekvivalent
kvantitativt mot massa, men aldrig skapa massa, och vilket redan framgår i ENERGILAGEN
enligt relaterad fysik.
Se även i ENTROPIBEGREPPET i relaterad fysik där irreversibilitetsbegreppet behandlas utförligt genom
jämförande exempel, se särskilt i Kausalordningen [Fysikens lagar är orsaksbaserade] och Arbetsexempel,
Utförligt
Arbetsexempel 1-3, Exempel
genom Wikipedia och Entropin i konkreta praktiska exempel.
Se även i Skapelse eller delning, samt Neutronfragmenten där ovannämnda aspekter beskrivs mera fördjupat [Kosmiska
strålningen kontra partikelacceleratorer] i ljuset av experimentalfysiken
och de olika svårigheterna i samband med tolkningsföreträdena TNED/MAC.
QED-historien från början — Omfattande, utförligt med
historiken till Bethe-Heitler-processen:
PAIR
PRODUCTION AND BREMSSTRAHLUNG OF CHARGED LEPTONS — Yung-Su Tsai, Stanford
Linear Accelerator Center, 1974
http://www.slac.stanford.edu/cgi-wrap/getdoc/slac-pub-1365.pdf
Boktypografisk
version finns nedan, men texten kan inte kopieras,
http://www.physics.isu.edu/~tforest/Classes/NucSim/Day8/Tsai_ScreeningFunctions_Rev.Mod.Phys._vol46_pg815_1974.pdf
Sidhänvisningarna
i citaten här anges med bägge respektive ovanstående dokument typ »s1mö|s815sp1n»
’materia från laser’
————————————————————————
»Klassisk parbildning» generellt från elektronstrålning
e– →| Z | ~~~ γ → ± X
En elektronstråle får träffa ett
materiellt strålmål Z (vanligen någon form av metallfolie eller tunn tråd [‡1]);
den snabba inbromsningen av de elektriskt laddade elektronerna skapar en stark
och snabb induktionsspänningstransient (stoppstrålning eller bromsstrålning)
γ; är elektronenergin tillräcklig i energi-massa-ekvivalenter, kan
motsvarande materiella parbildning ±X framträda ur Z via e genom γ.
Massa-energi-ekvivalenterna garanterar genom energilagen
att fysiken tvunget, obönhörligt, måste genomföra en sådan ordning (naturen
lyder den matematiska fysikens ekvivalenter).
”The
work on this paper started about ten years ago when Stanford Linear Accelerator
Center was still under construction. At that ,time like any other new high
energy physics. laboratory, people were concerned with problems such as what
would be the yields of muons, pions, K mesons, antiprotons etc. and also
whether any new particles such as W bosons and heavy leptons could be discovered
by the new machine.”,
;
”In
the electron machine these particles are produced by the bremstrahlung beam which in turn is
produced by the electron. Hence one has to
know accurately the properties of the bremsstrahlung beam in a fairly thick target. The pair production is related to the bremsstrahlung
problem by a substitution rule, thus the electron pair production cross section
can
be calculated trivially once we know how to calculate the bremsstrahlung by
electrons.”, s1mö|s815sp1n,
Bethe-Heitlers banbrytande bidrag
”Bethe and Heitler13 (1934) treated both the bremsstrahlung and
the pair production relativistically using
the Born approximation, in which the screening of the nuclear coulomb field was properly taken into account. Wheeler and Lamb14
(1939, 1956) treated the same phenomena in the field of atomic electrons.”,
”Experimentally, the productions
in the nuclear coulomb field and the electron field always occur together, hence two effects must be combined in order to make
comparison with experiments.”,
”When
the atomic number Z is large, the correction to the one photon exchange
mechanism must be included and this was done by Bethe and Maximonl5
(1954), Davies, Bethe and Maximo16 (1954), and Olsen17
(1955). It should be noted that in Bethe and Maximon, l5 it was
erroneously stated that the Coulomb correction affects only the pair production
but not the bremsstrahlung. This error was corrected by Olsen l7 (1955).”,
s5m|s816sp2m,
”Bethe and Heitler13 (1934)
treated a special case in which the target particle is an infinitely heavy pointlike and
spinless nucleus whose coulomb field is
screened by atomic electrons. They did not include the atomic excitation of the
target which was later considered by Wheeler and Lamb (1939).l4”,
”While
these treatments by Bethe and Heitler13 combined with the work of
Wheeler and Lamb14 adequately describe the pair production of electrons at high energies
and small angles, they are not adequate to
describe the pair production of particles with mass of muons or heavier,
because the effects of nuclear form factors and the recoil of the target system
must be included when heavy particles are produced.”,
”Even
in the electron pair production the nuclear form factors and the recoil must be
taken into account if the production angle is large. In fact when the
transverse momentum of the particle produced is much larger than the mass, the
cross section is nearly independent of the mass of the particle produced.”,
”Drell
and Walecka (1964)38 generalized the result of Bethe and Heitler to deal with a
target of arbitrary mass, spin and form factors and arbitrary final states.”,
s9ö|s817sp2mn,
——————————
Citatreferenser,
speciella
”2. In practice, pair
production and bremsstrahlung take place in a medium of finite
thickness (except in the colliding beam
experiments), the effect of which must be taken’into account in actual
applications of the theory.”, s6m|s817sp1ö,
Se även Bethe-Heitler
processen
»Bethe-Heitler mekanismen»
”the emission observed from the passage of e.g. electrons in thin amorphous foils (the Bethe-Heitler
mechanism)”, s3m,
Experimental
Investigations of the Interaction of Multi-GeV Particles with Strong
Crystalline Fields — Ulrik Mikkelsen,
1997
http://phys.au.dk/fileadmin/site_files/publikationer/phd/Ulrik_Mikkelsen.pdf
Återigen:
många författare använder termen/begreppet ’Bethe-Heitler mechanism’, få ger
någon förklarande beskrivning. Ovan ett av de få undantagen.
kalkylkortet nedan DIREKT FRÅN DEN
HÄR WEBBLÄSAREN Casimir.ods — se
öppningsmanual
om ej redan bekant — eller kopiera
URL:en nedan till valfri webbläsare (vilket som fungerar — förutsatt att
SVENSKA VERSIONEN av gratisprogramvaran OPEN OFFICE finns installerad på
datorn)
http://www.universumshistoria.se/AaKort/Casimir.ods
Kalkylkortet
Casimir.ods
KALKYLKORT ingår generellt i UNIVERSUMS
HISTORIA för dokumentpresentationer där mera omfattande beräkningsarbeten
ingår. Allt annat är uteslutet FÖR DEN RELATERADE FRAMSTÄLLNINGENS SKULL — man
ska kunna följa framställningssättet i de avgörande partierna genom att själv
utföra och kontrollera beräkningsprocedurerna — och ev. också kunna utverka
egna utvecklingar om tid och intresse finns.
En
fullständig manual till varje kalkylblock ligger emellertid utanför ramen för
presentationen: endast partierna i huvudsak beskrivs, som nedan, illustrerat,
med vissa förtydliganden. Kalkyldelarna är i vilket fall tänkta att kunna
förstås (improviserat) av den som är insatt i framställningens detaljer.
Tabellflik 1
Casimireffekten — med
Platta-Sfärsamband enligt Prevenslik,
Mohideen, Klimchitskaya
Kontrollräkning | Jämförande tabeller —
Kovalenta bindningar | Väte

ÄMNESTABELL till Casimireffekten — Alla
materialvärden vid rumstemperatur
Lambväxlingen [äv. Lambövergången el. Lambskiftet] |
Okt2010 — med alternativa CODATA-konstanter

iteration Unit1 — Casimireffekten 23Okt2010

Tabellflik 2
Elektronens
g-faktor — jämförande värden | Okt2010

Tabellflik 3
ELEKTRONENvdW — van der Waals krafter
Jämförande
tabeller — Kovalenta bindningar
Jämförande
metallbindningar

Casimireffekten Tabellflik 1:
Huvudkort


Inmatning | Resultat
innehåll: SÖK på denna
sida Ctrl+F · sök alla ämnesord
överallt i SAKREGISTER · förteckning över alla webbsidor
Elektronen i materien —
Positronbildning · van der Waals krafter
ämnesrubriker
innehåll
Förklaringen
referenser
[HOP]. HANDBOOK OF PHYSICS, E. U. Condon, McGraw-Hill 1967
Atomviktstabellen i HOP allmän referens i denna presentation, Table 2.1 s9–65—9–86.
mn = 1,0086652u ...................... neutronmassan i atomära massenheter (u) [HOP Table 2.1 s9–65]
me = 0,000548598u .................. elektronmassan i atomära massenheter (u) [HOP Table 10.3 s7–155 för me , Table 1.4 s7–27 för u]
u = 1,66043 t27 KG .............. atomära massenheten [HOP Table 1.4 s7–27, 1967]
u = 1,66033
t27 KG .............. atomära massenheten [ENCARTA 99 Molecular
Weight]
u = 1,66041 t27 KG ............... atomära massenheten [FOCUS MATERIEN 1975 s124sp1mn]
u = 1,66053886 t27 KG ........ atomära massenheten [teknisk kalkylator, lista med konstanter SHARP EL-506W (2005)]
u = 1,6605402 t27 KG .......... atomära massenheten [@INTERNET (2007) sv. Wikipedia]
u = 1,660538782 t27 KG ...... atomära massenheten [från www.sizes.com],
CODATA rekommendation från 2006 med toleransen ±0,000 000 083 t27 KG (Committe on Data for Science and Technology)]
c0 = 2,99792458 T8 M/S ........ ljushastigheten i vakuum [ENCARTA 99 Light, Velocity, (uppmättes i början på 1970-talet)]
h = 6,62559 t34 JS ................. Plancks konstant [HOP s7–155]
e = 1,602 t19 C ...................... [ref. FOCUS MATERIEN 1975 s666]
ε0 = 8,8543 t12 C/VM ............. [ref. FOCUS MATERIEN 1975 s666]
BKL BONNIERS
KONVERSATIONSLEXIKON Band I-XII med Supplement A-Ö 1923-1929
t|T förenklad exponentbeteckning: t|T för 10^ – | +; EX.: t19 = 10–19
PREFIXEN FÖR bråkdelar och potenser av FYSIKALISKA STORHETER
Här används genomgående och konsekvent beteckningarna
förkortning för förenklad
potensbeteckning
d deci t1
c centi t2
m milli t3
µ mikro t6
n nano t9
p pico t12
f femto t15
Alla Enheter anges här i MKSA-systemet [Se International System of Units] (M meter, KG kilo[gram], S sekund, A ampere), alla med stor bokstav, liksom följande successiva tusenprefix:
K kilo T3
M mega T6
G giga T9
T tera T12
Exempel: Medan många skriver cm för centimeter skrivs här konsekvent cM (centiMeter).
MAC Ofta använd förkortning för
modern akademi (Modern ACademy) i Universums Historia.
TNED (Toroid Nuclear
Electromechanical Dynamics), eller Toroidnukleära Elektromekaniska Dynamiken är den dynamiskt ekvivalenta resultatbeskrivning som
följer av härledningarna i Planckringen h=mnc0rn,
analogt Atomkärnans Härledning. Beskrivningen enligt TNED är relaterad, vilket innebär: alla, samtliga, detaljer gör anspråk på
att vara fullständigt logiskt förklarbara och begripliga, eller så inte alls.
Med TNED förstås (således) också RELATERAD FYSIK OCH MATEMATIK. Se även uppkomsten av termen TNED i Atomkärnans Härledning (Planckfraktalerna).
OM man ska försöka lyfta fram något
CENTRALT — i syntes — i TNED kan det bara bli följande:
N3m20 — atomkärnans
härledning — kopplar direkt till
NEUTRONKVADRATEN via deuteronkopplingen [den centrala aggregattransformationen mellan de två
olika nukleära formfaktorerna i TNED som definierar grunderna för
fusionsfysiken] som kopplar ATOMVIKTERNA,
vilka direkt visar jämförelsen TNED-MAC.
UTVIDGAD ORDLISTA — ElektronenVdW.htm 2010
Materiallära,
grundbegrepp
Hållfasthetslära,
grundbegrepp
Hållfasthet,
materialfysiken
Brotthållfasthet,
materialfysiken
Brottgränsen (Rm),
materialfysiken
Hamakerbrottgränsen,
materialfysiken
Hamakerkonstanten
Hamakers konstant,
innebörd
Kohesion
Adhesion
Casimireffekten [mera
utförligt i ElektronenLEC.htm]
Casimirgraferna —
Jämförande intervall
Grundämnesmetallernas
brotthållfasthet — jämförelse Uppmätt-Beräknat, Diagram Rm 1-3
KJ/mol
Kovalenta
bindningsgeometrin
Vätebindningen H—H
van der Waals krafter
van der Waals krafter
inom kemin
Intermolekylära krafter —
webbreferenser
Hållfasthetsreferenser på
Webben — Grundläggande hållfasthetsbegrepp
Senast uppdaterade version: 2011-08-21.
*END.
Stavningskontrollerat 2010-11-12.
*
åter till portalsidan
· portalsidan är
www.UniversumsHistoria.se
τ π ħ √ ε UNICODE — ofta använda tecken
i matematiska-tekniska-naturvetenskapliga beskrivningar
σ ρ ν ν π τ γ
λ η ≠ √ ħ ω → ∞ ≡
Ω Φ Ψ Σ Π Ξ Λ Θ
Δ
α β γ δ ε λ θ κ
π ρ τ φ ϕ σ ω ϖ ∏ √ ∑
∂ ∆ ∫ ≤ ≈ ≥ ˂ ˃ ˂ ˃ ← ↑ → ∞ ↓
ϑ ζ ξ
Pilsymboler, direkt via tangentbordet: Alt+24 ↑; Alt+25
↓; Alt+26 →; Alt+27 ←; Alt+22 ▬
Alt+23 ↨ — även Alt+18 ↕; Alt+29
↔
PNG-justerad 2011-08-21
åter till portalsidan
· portalsidan är
www.UniversumsHistoria.se